解答题-原理综合题 适中0.65 引用2 组卷155
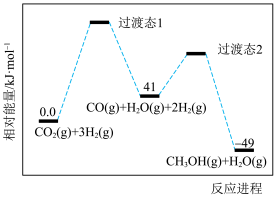
(1)已知25℃和101
②
则
(2)控制起始时
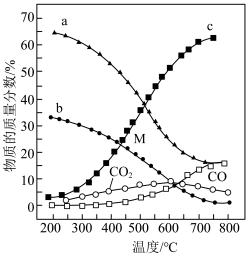
①平衡时
②温度高于500℃时,
(3)催化制氢是目前大规模制取氢气的方法之一:
①反应平衡常数
②保持K不变,提高
③由
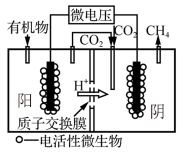
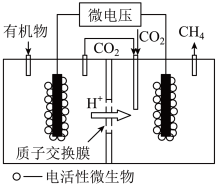
(4)近年来,生物电催化技术运用微生物电解池实现了
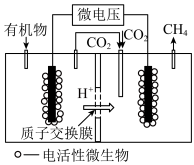
①微生物电解池实现
②如果处理有机物[
23-24高三上·四川·阶段练习
类题推荐
绿色能源是当今重要的研究热点,2022年3月12日,中科院大连化物所的 制汽油科研项目成功了,这是一项重大成功,直接影响的是国计民生。寻找新的能源成为了科学研究的热点。
制汽油科研项目成功了,这是一项重大成功,直接影响的是国计民生。寻找新的能源成为了科学研究的热点。
I. 甲烷化反应为:
甲烷化反应为: ,该反应又称Sabatier反应。
,该反应又称Sabatier反应。
(1)相关的化学键键能数据如下表所示:
Sabatier反应的
_______ 
(2)若要同时提高反应的速率和甲烷的平衡转化率,可以采取的措施有:_______ (写一点即可)。
(3)在体积为2L的恒温密闭容器中,投入1mol 、4mol
、4mol 进行上述反应,达到平衡后,若
进行上述反应,达到平衡后,若 的转化率为20%,则该反应的平衡常数的计算式为:
的转化率为20%,则该反应的平衡常数的计算式为:
_______  。
。
(4) 转化为
转化为 也可通过电化学反应实现,其原理如图所示:
也可通过电化学反应实现,其原理如图所示:
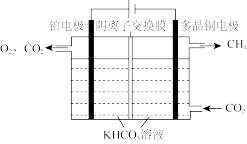
电解过程中,阴极室和阳极室的 溶液浓度基本保持不变。阴极的电极反应式为
溶液浓度基本保持不变。阴极的电极反应式为_______ ;若生成1mol 理论上阳极室生成混合气体的体积为
理论上阳极室生成混合气体的体积为_______ L(标准状况,忽略气体的溶解)。
Ⅱ.催化制氢是目前大规模制取氢气的方法之一:

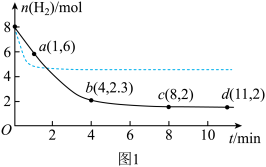
(5) ℃时,将0.10mol
℃时,将0.10mol 与0.40mol
与0.40mol 充入5L的容器中,反应平衡后
充入5L的容器中,反应平衡后 的物质的量分数
的物质的量分数 。根据实验数据计算得到
。根据实验数据计算得到 和
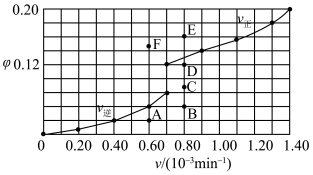
和 的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为
的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_______ (填字母)。

(6)研究表明, 催化变换反应的速率方程为:
催化变换反应的速率方程为: ,式中
,式中 、
、 、
、 、
、 分别表示相应的物质的量分数,
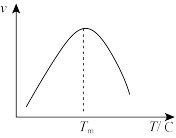
分别表示相应的物质的量分数, 为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。根据速率方程分析,
为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。根据速率方程分析, 时,v逐渐减小的原因是
时,v逐渐减小的原因是_______ 。
I.
(1)相关的化学键键能数据如下表所示:
| 化学键 | ||||
| 436 | 463 | 413 | 803 |
(2)若要同时提高反应的速率和甲烷的平衡转化率,可以采取的措施有:
(3)在体积为2L的恒温密闭容器中,投入1mol
(4)

电解过程中,阴极室和阳极室的
Ⅱ.催化制氢是目前大规模制取氢气的方法之一:
(5)

(6)研究表明,

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网