解答题-原理综合题 适中0.65 引用2 组卷720
苯乙烯是生产塑料和合成橡胶的重要有机原料,国内外目前生产苯乙烯的方法主要是乙苯催化脱氢法,反应方程式为:
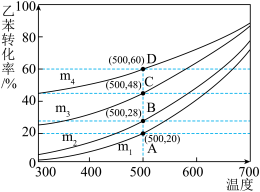
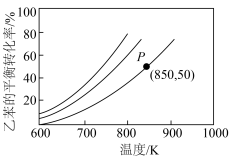
(1)实际生产过程中,通常向乙苯中掺混氮气(N2不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度变化关系如图所示(其中投料比m为原料气中乙苯和N2的物质的量之比,取值分别为1∶0、1∶1、1∶5、1∶9)。
①乙苯催化脱氢反应的
_______ 0(填“>”或“<”)。
②投料比m为1∶9的曲线是_______ (填m1、m2、m3或m4)。
③保持投料比不变,在恒温恒压的条件下进行反应,下列事实能作为该反应达到平衡的依据的是_______ (填字母)。
A. B.容器内气体密度不再变化
B.容器内气体密度不再变化
C.容器内苯乙烯与H2的分子数之比不再变化 D.容器内气体的平均相对分子质量不再变化
(2)近年来,有研究者发现若将上述生产过程中通入N2改为通入CO2,在CO2气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图:
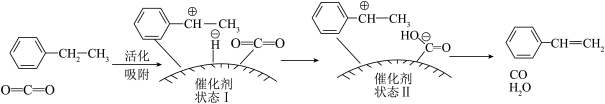
①该过程中发生的总反应化学方程式为_______ 。
②根据反应历程分析,催化剂表面酸碱性对乙苯脱氢反应性能影响较大,如果催化剂表面碱性太强,会降低乙苯的转化率,碱性太强使乙苯转化率降低的原因是_______ (写一点即可)。
③一定温度下,向恒容密闭容器中充入2mol乙苯和2molCO2起始压强为p0,若平衡时容器内气体总物质的量为5mol,乙苯的转化率为_______ ,用平衡分压代替平衡浓度表示的化学平衡常数Kp=_______ (用含p0的代数式表示,某气体平衡分压=总压×该气体物质的量分数)。

(1)实际生产过程中,通常向乙苯中掺混氮气(N2不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度变化关系如图所示(其中投料比m为原料气中乙苯和N2的物质的量之比,取值分别为1∶0、1∶1、1∶5、1∶9)。

①乙苯催化脱氢反应的
②投料比m为1∶9的曲线是
③保持投料比不变,在恒温恒压的条件下进行反应,下列事实能作为该反应达到平衡的依据的是
A.
C.容器内苯乙烯与H2的分子数之比不再变化 D.容器内气体的平均相对分子质量不再变化
(2)近年来,有研究者发现若将上述生产过程中通入N2改为通入CO2,在CO2气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图:

①该过程中发生的总反应化学方程式为
②根据反应历程分析,催化剂表面酸碱性对乙苯脱氢反应性能影响较大,如果催化剂表面碱性太强,会降低乙苯的转化率,碱性太强使乙苯转化率降低的原因是
③一定温度下,向恒容密闭容器中充入2mol乙苯和2molCO2起始压强为p0,若平衡时容器内气体总物质的量为5mol,乙苯的转化率为
23-24高三上·广东广州·阶段练习
类题推荐
苯乙烯是生产塑料与合成橡胶的重要原料,目前生产苯乙烯的方法主要为 氧化乙苯脱氢制苯乙烯,其反应如下:
氧化乙苯脱氢制苯乙烯,其反应如下:

(1)下列关于反应Ⅰ~Ⅲ的说法正确的是_______(填序号)。
(2)常压下,乙苯和 经催化剂吸附后才能发生反应Ⅰ.控制投料比[
经催化剂吸附后才能发生反应Ⅰ.控制投料比[ ]分别为1∶1、5∶1和10∶1,并在催化剂的作用下发生反应,乙苯的平衡转化率与反应温度的关系如图所示。
]分别为1∶1、5∶1和10∶1,并在催化剂的作用下发生反应,乙苯的平衡转化率与反应温度的关系如图所示。_______ (填“高”或“低”)。
②850K时,反应经t min达到图中P点所示状态,若初始时乙苯的物质的量为n mol,则v(苯乙烯)=_______ mol/min。
(3)一定温度下,向恒容密闭容器中充入2mol乙苯和2mol ,起始压强为
,起始压强为 kPa,若容器中只发生反应Ⅰ,平衡时容器内气体的总物质的量为5mol,乙苯的转化率为
kPa,若容器中只发生反应Ⅰ,平衡时容器内气体的总物质的量为5mol,乙苯的转化率为_______ ,用平衡分压代替平衡浓度表示的化学平衡常数
_______ kPa。
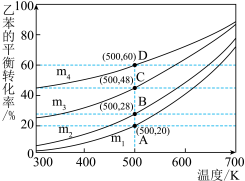
(4)若在生产过程中只发生反应Ⅱ,向乙苯中混入氮气( 不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度的变化关系如图所示(其中投料比m为原料气中乙苯和
不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度的变化关系如图所示(其中投料比m为原料气中乙苯和 的物质的量之比,取值分别为1∶0、1∶1、1∶5、1∶9)。
的物质的量之比,取值分别为1∶0、1∶1、1∶5、1∶9)。_______ (填“ ”“
”“ ”“
”“ ”或“
”或“ ”),图中A与B两点相比,乙苯的活化分子百分数A
”),图中A与B两点相比,乙苯的活化分子百分数A_______ (填“>”“=”或“<”)B。
反应Ⅰ: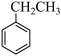 (g)+CO2(g)
(g)+CO2(g)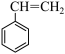 (g)+H2O(g)+CO(g)
(g)+H2O(g)+CO(g)
反应Ⅱ: (g)
(g) (g)+H2(g)
(g)+H2(g)
(1)下列关于反应Ⅰ~Ⅲ的说法正确的是_______(填序号)。
| A.及时分离出水蒸气,有利于提高平衡混合物中苯乙烯的含量 |
| B. |
| C.其他条件相同,反应Ⅱ分别在恒容和恒压的条件下进行,前者乙苯的平衡转化率更高 |
| D.对于基元反应Ⅲ,正反应的活化能小于逆反应的活化能 |
(2)常压下,乙苯和
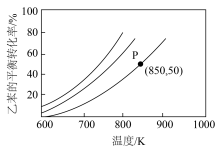
②850K时,反应经t min达到图中P点所示状态,若初始时乙苯的物质的量为n mol,则v(苯乙烯)=
(3)一定温度下,向恒容密闭容器中充入2mol乙苯和2mol
(4)若在生产过程中只发生反应Ⅱ,向乙苯中混入氮气(
苯乙烯是生产塑料与合成橡胶的重要原料,目前生产苯乙烯的方法主要为 氧化乙苯脱氢制苯乙烯,其反应如下:
氧化乙苯脱氢制苯乙烯,其反应如下:

(1)反应I的
___________ 。
(2)下列关于反应I~Ⅲ的说法正确的是___________(填序号)。
(3)常压下,乙苯和 经催化剂吸附后才能发生反应I。控制投料比[
经催化剂吸附后才能发生反应I。控制投料比[ (乙苯)]分别为1∶1、5∶1和10∶1,并在催化剂的作用下发生反应,乙苯的平衡转化率与反应温度的关系如图所示。
(乙苯)]分别为1∶1、5∶1和10∶1,并在催化剂的作用下发生反应,乙苯的平衡转化率与反应温度的关系如图所示。___________ (填“高”或“低”)。
②850K时,反应经tmin达到图中P点所示状态,若初始时乙苯的物质的量为nmol,则v(苯乙烯)=___________ mol/nim。
(4)一定温度下,向恒容密闭容器中充入2mol乙苯和 ,起始压强为
,起始压强为 ,若容器中只发生反应I,平衡时容器内气体的总物质的量为5mol,乙苯的转化率为
,若容器中只发生反应I,平衡时容器内气体的总物质的量为5mol,乙苯的转化率为___________ ,用平衡分压代替平衡浓度表示的化学平衡常数
___________ kPa。
(5)若在生产过程中只发生反应Ⅱ,向乙苯中混入氮气( 不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度的变化关系如图所示(其中投料比m为原料气中乙苯和
不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度的变化关系如图所示(其中投料比m为原料气中乙苯和 的物质的量之比,取值分别为1∶0、1∶1、1∶5、1∶9)。
的物质的量之比,取值分别为1∶0、1∶1、1∶5、1∶9)。___________ (填“ ”“
”“ ”“
”“ ”或“
”或“ ”),图中A与B两点相比,乙苯的活化分子百分数A
”),图中A与B两点相比,乙苯的活化分子百分数A___________ (填“>”“=”或“<”)B。
(6)从资源综合利用的角度分析, 氧化乙苯脱氢制苯乙烯的优点是
氧化乙苯脱氢制苯乙烯的优点是___________ 。
反应I: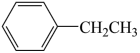 (g)+CO2(g)
(g)+CO2(g) (g)+H2O(g)+CO(g)
(g)+H2O(g)+CO(g)
反应Ⅱ: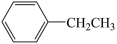 (g)⇌
(g)⇌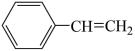 (g)+H2(g)
(g)+H2(g)
(1)反应I的
(2)下列关于反应I~Ⅲ的说法正确的是___________(填序号)。
| A.及时分离出水蒸气,有利于提高平衡混合物中苯乙烯的含量 |
| B. |
| C.其他条件相同,反应Ⅱ分别在恒容和恒压的条件下进行,前者乙苯的平衡转化率更高 |
| D.对于基元反应Ⅲ,正反应的活化能小于逆反应的活化能 |
(3)常压下,乙苯和
②850K时,反应经tmin达到图中P点所示状态,若初始时乙苯的物质的量为nmol,则v(苯乙烯)=
(4)一定温度下,向恒容密闭容器中充入2mol乙苯和
(5)若在生产过程中只发生反应Ⅱ,向乙苯中混入氮气(
(6)从资源综合利用的角度分析,
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 (g)
(g)  (g) +H2(g)
(g) +H2(g)
 (g)+CO2(g)
(g)+CO2(g) (g)+CO(g)+H2O(g)
(g)+CO(g)+H2O(g)


