解答题-原理综合题 较难0.4 引用1 组卷74
利用1—甲基萘(1— )制备四氢萘类物质(
)制备四氢萘类物质( ,包括1—
,包括1— 和5—
和5— )。反应过程中伴有生成十氢茶(1—
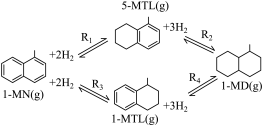
)。反应过程中伴有生成十氢茶(1— )的副反应,涉及反应如图:
)的副反应,涉及反应如图:

回答下列问题:
(1)已知一定条件下反应 的焓变分别为
的焓变分别为 ,则反应
,则反应 的焓变为
的焓变为_____ (用含 的代数式表示)。
的代数式表示)。
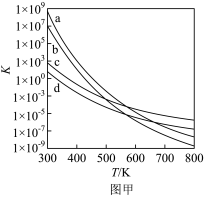
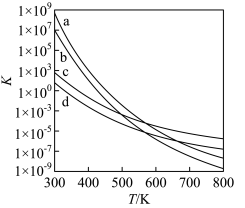
(2)四个平衡体系的平衡常数与温度的关系如图甲所示。
①c、d分别为反应 和
和 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应 的平衡常数随温度变化曲线为
的平衡常数随温度变化曲线为_____ 。
②已知反应 的速率方程
的速率方程 (
( 分别为正、逆反应速率常数,只与温度、催化剂有关)。温度
分别为正、逆反应速率常数,只与温度、催化剂有关)。温度 下反应达到平衡时
下反应达到平衡时 ,温度
,温度 下反应达到平衡时
下反应达到平衡时 。由此推知,
。由此推知,
_____  。(填“>”,“<”或“=”)。
。(填“>”,“<”或“=”)。
③下列说法错误的是_____ 。
A.四个反应均为放热反应
B.压强越大,温度越低越有利于生成四氢萘类物质
C.反应体系中1— 最稳定
最稳定
D.由上述信息可知, 时反应
时反应 速率最快
速率最快
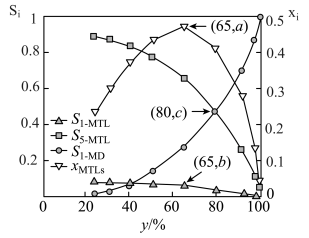
(3)1— 在
在 的高压
的高压 氛围下反应(
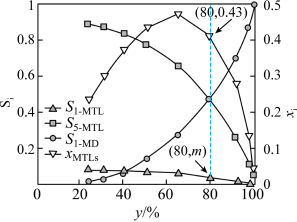
氛围下反应( 压强近似等于总压)。不同温度下达平衡时各产物的选择性
压强近似等于总压)。不同温度下达平衡时各产物的选择性 (某生成物i的物质的量与消耗1—
(某生成物i的物质的量与消耗1— 的物质的量之比)和物质的量分数
的物质的量之比)和物质的量分数 (
( 表示物种i与除
表示物种i与除 外其他各物种总物质的量之比)随1—
外其他各物种总物质的量之比)随1— 平衡转化率y的变化关系如图乙所示,1—
平衡转化率y的变化关系如图乙所示,1— 平衡转化率y为80%时,1—
平衡转化率y为80%时,1— 的产率=
的产率=_____ ;y为65%时反应 的平衡常数
的平衡常数
_____  。四氢萘类物质的物质的量分数
。四氢萘类物质的物质的量分数 随1—
随1— 平衡转化率先增大后减小,结合平衡移动原理解释原因
平衡转化率先增大后减小,结合平衡移动原理解释原因_____ 。

回答下列问题:
(1)已知一定条件下反应
(2)四个平衡体系的平衡常数与温度的关系如图甲所示。

①c、d分别为反应
②已知反应
③下列说法错误的是
A.四个反应均为放热反应
B.压强越大,温度越低越有利于生成四氢萘类物质
C.反应体系中1—
D.由上述信息可知,
(3)1—
23-24高二上·山西太原·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
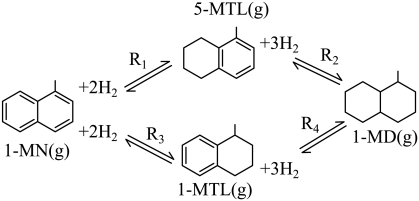
 +2H2(g)
+2H2(g)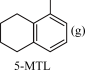 ;ΔH1
;ΔH1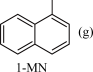 +2H2(g)
+2H2(g) ;ΔH2
;ΔH2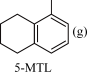 +3H2(g)
+3H2(g) ;ΔH3
;ΔH3 +3H2(g)
+3H2(g)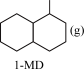 ;ΔH4
;ΔH4