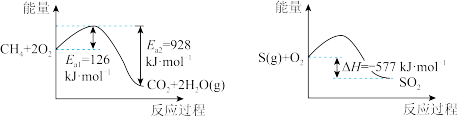解答题-原理综合题 适中0.65 引用1 组卷112
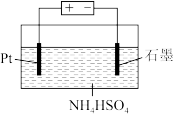
Ⅰ.实验室用如图所示简易量热计进行中和热的测定实验,请回答。
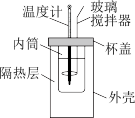
(1)简易量热计有利于减小误差的设计措施有_____ 、_____ 。
(2)分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行反应,经测定并计算得出该反应放出的热量为QkJ。写出其热化学方程式_____ 。
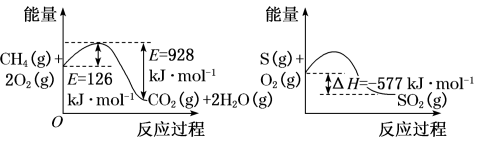
Ⅱ.在I-存在下,H2O2分解的反应历程为:
①
②
其反应过程的能量变化如图所示,回答下列问题:
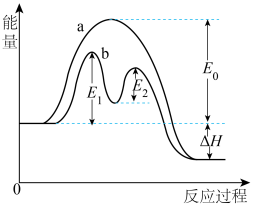
(3)在I-存在下,H2O2分解过程的最大能垒(活化能)为_____ ,决定总反应速率的是第_____ 步基元反应,
(4)反应过程中I-和IO-的浓度变化趋势为_____。
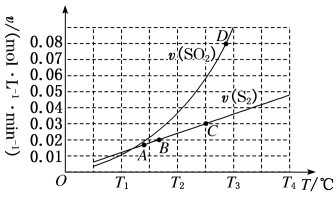
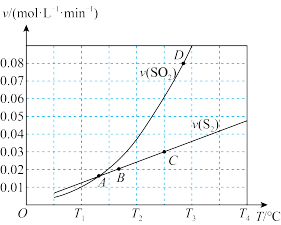
Ⅲ.向1L容器中加入1molSO2和足量焦炭,发生反应2C(s)+2SO2(g) S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
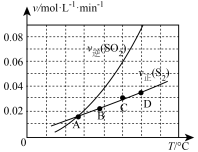
(5)A、B、C、D四点对应的状态中,达到平衡状态的有_____ (填字母)。
(6)该反应的△H_____ 0(填>、<或=)。
(7)下列措施能够增大SO2平衡转化率的是_____。

(1)简易量热计有利于减小误差的设计措施有
(2)分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行反应,经测定并计算得出该反应放出的热量为QkJ。写出其热化学方程式
Ⅱ.在I-存在下,H2O2分解的反应历程为:
①
②
其反应过程的能量变化如图所示,回答下列问题:

(3)在I-存在下,H2O2分解过程的最大能垒(活化能)为
(4)反应过程中I-和IO-的浓度变化趋势为_____。
A.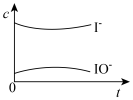 | B.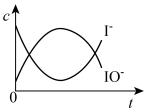 |
C.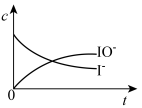 | D.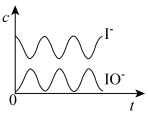 |
Ⅲ.向1L容器中加入1molSO2和足量焦炭,发生反应2C(s)+2SO2(g)

(5)A、B、C、D四点对应的状态中,达到平衡状态的有
(6)该反应的△H
(7)下列措施能够增大SO2平衡转化率的是_____。
| A.降温 | B.增加C(s)的量 | C.减小容器体积 | D.恒压通入一定量SO2 |
22-23高二上·浙江嘉兴·阶段练习
类题推荐
燃煤烟气的脱硫脱硝是目前研究的热点。回答下列问题:
(1)用 CH4 催化还原氮氧化物可以消除氮氧化物污染,涉及反应如下:
I.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ∆H=-574kJ/mol
II.CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ∆H=-1160kJ/mol
III.H2O(g)=H2O(l) ∆H=-44kJ/mol
则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) ∆H=_________ kJ/mol
(2)某科研小组研究臭氧氧化-碱吸收法同时脱除 SO2 和 NO工艺,氧化过程反应原理及反应热、活化能数据如表:
其他条件不变,每次向容积为2L的反应器中充入含1.0molNO、1.0molSO2 的混合气和 2.0molO3,改变温度,反应相同时间t 后,体系中NO 和 SO2 的转化率如图所示。
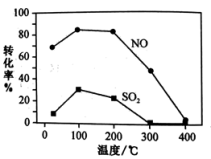
①由图可知相同温度下 NO 的转化率远高于 SO2,结合题中数据分析其可能原因:_______
②温度高于200℃后,NO和SO2的转化率随温度升高显著下降的可能原因是_______
③若其他条件不变,缩小反应器的容积,NO 和 SO2的平衡转化率_______ (填“增大”“减小”或“不变”)
(3)在一定条件下,焦炭催化还原SO2的化学方程式为:2C(s)+2SO2(g)⇌S2(g)+2CO2(g)
①该反应的逆反应速率表达式:v逆=k逆·c(S2)·c2(CO2),k逆为速率常数(仅与温度有关)。表为某温度下,测得的实验数据:
由表中数据可知,该温度下,上述反应的逆反应速率常数 k逆=_______ L2·mol-2·min-1
②一定压强下,向1L 密闭容器中加入足量的焦炭和 1molSO2 发生上述反应,反应 10min 时,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
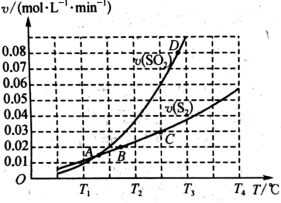
根据图象,判断反应2C(s)+2SO2(g)⇌S2(g)+2CO2(g)的∆H_______ (填“>”“<”“=”)0 A、B、C、D 四点对应的状态中,达到平衡状态的有_______ (填字母),该点对应的温度下的化学平衡常数K=_______
(1)用 CH4 催化还原氮氧化物可以消除氮氧化物污染,涉及反应如下:
I.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ∆H=-574kJ/mol
II.CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ∆H=-1160kJ/mol
III.H2O(g)=H2O(l) ∆H=-44kJ/mol
则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) ∆H=
(2)某科研小组研究臭氧氧化-碱吸收法同时脱除 SO2 和 NO工艺,氧化过程反应原理及反应热、活化能数据如表:
| 反应 | 反应热(∆H1)/kJ | 活化能(Ea1)//kJ |
| NO(g)+O3(g)⇌NO2(g)+O2(g) | -200.9 | 3.2 |
| SO2(g)+O3(g) | -241.6 | 58 |
| 臭氧分解:2O3(g)⇌3O2(g) |

①由图可知相同温度下 NO 的转化率远高于 SO2,结合题中数据分析其可能原因:
②温度高于200℃后,NO和SO2的转化率随温度升高显著下降的可能原因是
③若其他条件不变,缩小反应器的容积,NO 和 SO2的平衡转化率
(3)在一定条件下,焦炭催化还原SO2的化学方程式为:2C(s)+2SO2(g)⇌S2(g)+2CO2(g)
①该反应的逆反应速率表达式:v逆=k逆·c(S2)·c2(CO2),k逆为速率常数(仅与温度有关)。表为某温度下,测得的实验数据:
| S2的浓度/(mol/L) | CO2的浓度/(mol/L) | 逆反应速率/(mol |
| 0.1 | c1 | 9.6 |
| c2 | c1 | 19.2 |
| c2 | 0.3 | 64.8 |
②一定压强下,向1L 密闭容器中加入足量的焦炭和 1molSO2 发生上述反应,反应 10min 时,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:

根据图象,判断反应2C(s)+2SO2(g)⇌S2(g)+2CO2(g)的∆H
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网