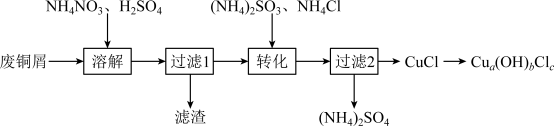
解答题-工业流程题 较难0.4 引用1 组卷151
葡萄糖酸锌是一种抗缺锌药物,可由 为原料制得。工业上以废锌铁合金(主要成分为Zn,含有少量的Fe、Fe2O3、ZnO、CuO和油污等杂质)为原料制备
为原料制得。工业上以废锌铁合金(主要成分为Zn,含有少量的Fe、Fe2O3、ZnO、CuO和油污等杂质)为原料制备 的流程如图。
的流程如图。

(1)碱洗的目的是___________ 。
(2)氧化时发生反应的离子方程式为___________ 。
(3)取“氧化”过程中的上层清液,滴加酸性 稀溶液,紫红色褪去,可能的原因是
稀溶液,紫红色褪去,可能的原因是_____ 。
(4)由过滤所得的滤液为原料制备 ,请补充完整相应的实验方案:向滤液中
,请补充完整相应的实验方案:向滤液中___________ ,过滤、晾干,得到 。
。
实验中须用到的试剂:锌粉、 。
。
(5)以 为原料可制得葡萄糖酸锌
为原料可制得葡萄糖酸锌 。为测定葡萄糖酸锌样品的纯度,进行下列实验。
。为测定葡萄糖酸锌样品的纯度,进行下列实验。
步骤1:称取5.200g样品溶于水配成100mL溶液,取25.00mL置于锥形瓶中,滴入少量的铬黑T作指示剂。
步骤2:向锥形瓶中加入过量的 ,振荡。
,振荡。
步骤3:用 锌标准溶液滴定过量的EDTA至终点,消耗锌标准溶液16.00mL(已知:
锌标准溶液滴定过量的EDTA至终点,消耗锌标准溶液16.00mL(已知: 与EDTA反应的化学计量比为1∶1)。
与EDTA反应的化学计量比为1∶1)。
①计算此产品中锌元素的质量分数:___________ 。(写出计算过程)
②葡萄糖酸锌中锌元素的含量为14.28%,对照①计算结果,产生误差的可能原因是(样品纯或不纯)___________ 。

(1)碱洗的目的是
(2)氧化时发生反应的离子方程式为
(3)取“氧化”过程中的上层清液,滴加酸性
(4)由过滤所得的滤液为原料制备
实验中须用到的试剂:锌粉、
(5)以
步骤1:称取5.200g样品溶于水配成100mL溶液,取25.00mL置于锥形瓶中,滴入少量的铬黑T作指示剂。
步骤2:向锥形瓶中加入过量的
步骤3:用
①计算此产品中锌元素的质量分数:
②葡萄糖酸锌中锌元素的含量为14.28%,对照①计算结果,产生误差的可能原因是(样品纯或不纯)
22-23高三上·江苏盐城·阶段练习
类题推荐
锌是人体必须的一种微量元素,素有“生命之花”的美誉。工业上利用废锌铁合金(主要为Zn,含少量Fe、ZnO、Fe2O3等)和葡萄糖酸钙[ Ca(C6H11O7)2]为原料制备并测定葡萄糖酸锌纯度的流程如下:
I.葡萄糖酸锌[Zn(C6H11O7))2]的制备
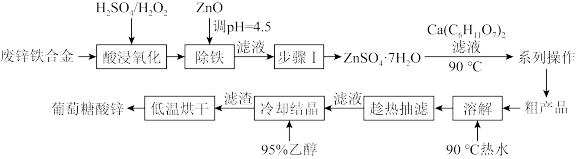
(1)加过量ZnO的目的是_______ (用离子方程式表示)。。
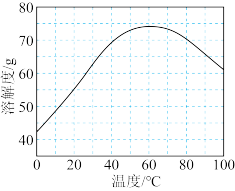
(2)已知ZnSO4的溶解度随温度变化如图所示,“步骤I”的操作是:在100℃蒸发溶剂;_______ ;_______ ;_______ ;冷却至室温;过滤。
(3)“趁热抽滤”的目的是_______ 。
(4)已知相关物质的溶解性如下表:
则实验中加入95%乙醇的目的是_______ 。
II.葡萄糖酸锌的纯度测定
制得产品之后,需要对产品的纯度进行测定以确定是否满足要求。以铬黑T(EBT)作为指示剂,用EDTA进行测定,原理为Zn2+与EBT作用可形成酒红色微粒Zn-EBT,由于EDTA与Zn2+结合能力更强,发生如下反应:Zn-EBT(酒红色)+EDTA=Zn-EDTA+EBT(纯蓝色)。
其步骤如下:
步骤1.取5.200 g产品溶于水配成100 mL溶液,取25. 00 mL置于锥形瓶中,再加入少量EBT作指示剂;
步骤2.在25.00mL溶液中加入2.000mol•L-1EDTA10.00mL(过量);
步骤3.用1.000 mol•L-1锌标准溶液滴定至终点,平均消耗锌标准溶液18.00mL。
(5)步骤2中EDTA溶液已加过量时溶液的颜色为_______ 。
(6)样品中葡萄糖酸锌的质量分数为_______ 。
I.葡萄糖酸锌[Zn(C6H11O7))2]的制备

(1)加过量ZnO的目的是
(2)已知ZnSO4的溶解度随温度变化如图所示,“步骤I”的操作是:在100℃蒸发溶剂;

(3)“趁热抽滤”的目的是
(4)已知相关物质的溶解性如下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸锌 | 硫酸锌 | 硫酸钙 |
| 水中的溶解性 | 易溶于热水 可溶于冷水 | 易溶于热水 可溶于冷水 | 易溶 | 微溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 难溶 | 难溶 |
II.葡萄糖酸锌的纯度测定
制得产品之后,需要对产品的纯度进行测定以确定是否满足要求。以铬黑T(EBT)作为指示剂,用EDTA进行测定,原理为Zn2+与EBT作用可形成酒红色微粒Zn-EBT,由于EDTA与Zn2+结合能力更强,发生如下反应:Zn-EBT(酒红色)+EDTA=Zn-EDTA+EBT(纯蓝色)。
其步骤如下:
步骤1.取5.200 g产品溶于水配成100 mL溶液,取25. 00 mL置于锥形瓶中,再加入少量EBT作指示剂;
步骤2.在25.00mL溶液中加入2.000mol•L-1EDTA10.00mL(过量);
步骤3.用1.000 mol•L-1锌标准溶液滴定至终点,平均消耗锌标准溶液18.00mL。
(5)步骤2中EDTA溶液已加过量时溶液的颜色为
(6)样品中葡萄糖酸锌的质量分数为
锌是人体必须的一种微量元素,素有“生命之花”的美誉。工业上利用废锌铁合金(主要为Zn,含少量Fe、ZnO、Fe2O3等)和葡萄糖酸钙[Ca(C6H11O7)2]为原料制备并测定葡萄糖酸锌纯度的流程如图:
I.葡萄糖酸锌[Zn(C6H11O7)2]的制备
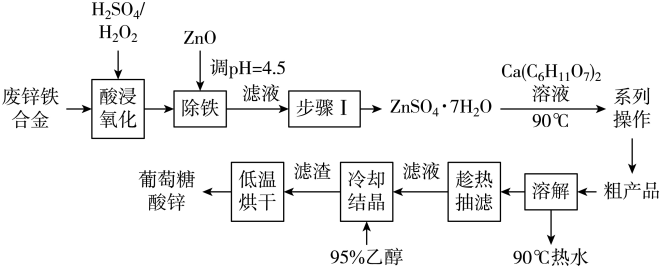
(1)加过量ZnO的目的是____ (用离子方程式表示)。
(2)已知ZnSO4的溶解度随温度变化如图所示,“步骤I”需要用到下列所有操作:

a.蒸发至溶液出现晶膜,停止加热;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。
上述操作的正确顺序是____ (操作可重复使用)。
(3)“趁热抽滤”的目的是___ 。
(4)已知相关物质的溶解性如表:
则实验中加入95%乙醇的目的是____ 。
(5)从粗产品到产品的过程简称为____ 。
II.葡萄糖酸锌的纯度测定
制得产品之后,需要对产品的纯度进行测定以确定是否满足要求。以铬黑T(EBT)作为指示剂,用EDTA进行测定,原理为Zn2+与EBT作用可形成酒红色微粒Zn—EBT,由于EDTA与Zn2+结合能力更强,发生如下反应:
Zn—EBT(酒红色)+EDTA=Zn—EDTA+EBT(纯蓝色)
其步骤如下:
步骤1.取5.200g产品溶于水配成100mL溶液,取25.00mL置于锥形瓶中,再加入少量EBT作指示剂;
步骤2.在25.00mL溶液中加入2.000mol·L-1EDTA10.00mL(过量);
步骤3.用1.000mol.L-1锌标准溶液进行滴定至终点,平均消耗锌标准溶液18.00mL。
(6)步骤2中EDTA溶液已加过量时溶液的颜色为____ 。
(7)样品中葡萄糖酸锌的质量分数为____ 。(葡萄糖酸锌的相对分子质量为455)
I.葡萄糖酸锌[Zn(C6H11O7)2]的制备

(1)加过量ZnO的目的是
(2)已知ZnSO4的溶解度随温度变化如图所示,“步骤I”需要用到下列所有操作:

a.蒸发至溶液出现晶膜,停止加热;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。
上述操作的正确顺序是
(3)“趁热抽滤”的目的是
(4)已知相关物质的溶解性如表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸锌 | 硫酸锌 | 硫酸钙 |
| 水中的溶解性 | 易溶于热水,可溶于冷水 | 易溶于热水,可溶于冷水 | 易溶 | 微溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 难溶 | 难溶 |
(5)从粗产品到产品的过程简称为
II.葡萄糖酸锌的纯度测定
制得产品之后,需要对产品的纯度进行测定以确定是否满足要求。以铬黑T(EBT)作为指示剂,用EDTA进行测定,原理为Zn2+与EBT作用可形成酒红色微粒Zn—EBT,由于EDTA与Zn2+结合能力更强,发生如下反应:
Zn—EBT(酒红色)+EDTA=Zn—EDTA+EBT(纯蓝色)
其步骤如下:
步骤1.取5.200g产品溶于水配成100mL溶液,取25.00mL置于锥形瓶中,再加入少量EBT作指示剂;
步骤2.在25.00mL溶液中加入2.000mol·L-1EDTA10.00mL(过量);
步骤3.用1.000mol.L-1锌标准溶液进行滴定至终点,平均消耗锌标准溶液18.00mL。
(6)步骤2中EDTA溶液已加过量时溶液的颜色为
(7)样品中葡萄糖酸锌的质量分数为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网