解答题-原理综合题 适中0.65 引用1 组卷164
我国提出争取在2030年前实现碳达峰,2060年前实现碳中和,这对于改变环境、实现绿色发展至关重要。因此,研发CO2利用技术、降低空气中CO2含量成为化学科学家研究的热点。回答下列问题:
(1)利用工业废气中的CO2可制取甲醇,其反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0。为探究用CO2生产燃料CH3OH的反应原理,现进行如下实验:在T℃时,向2L恒容密闭容器中充入1molCO2和3molH2,进行上述反应,10min时反应达到平衡,0~10min内,H2的反应速率为0.09mol•L-1•min-1。该温度下的平衡常数K=
CH3OH(g)+H2O(g) △H<0。为探究用CO2生产燃料CH3OH的反应原理,现进行如下实验:在T℃时,向2L恒容密闭容器中充入1molCO2和3molH2,进行上述反应,10min时反应达到平衡,0~10min内,H2的反应速率为0.09mol•L-1•min-1。该温度下的平衡常数K=______ (保留三位有效数字)。
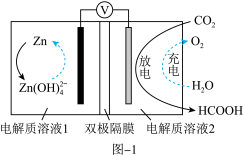
(2)电化学法将CO2转化为甲酸。科学家近年发明了一种新型Zn-CO2水介质电池。如图1所示,电极分别为金属铈和选择性催化材料,放电时,CO2被转化为储氢物质甲酸。注:双极隔膜为一层阳离子交换膜和一层阴离子交换膜复合而成,中间为水,作为电解质溶液中H+和OH-的来源。
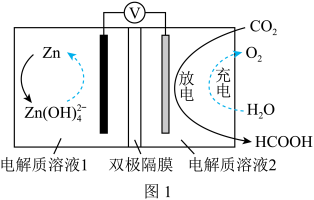
①放电时,正极电极反应式为______ 。
②与Zn极室相连的离子交换膜为______ 。
(3)热化学法将CO2转化为甲醇。CO2催化加氢主要反应有:
反应I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.4kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.4kJ•mol-1
反应Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.2kJ•mol-1
CO(g)+H2O(g) △H2=+41.2kJ•mol-1
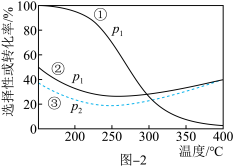
压强分别为p1、p2时,将 =1:3的混合气体置于密闭容器中反应,不同温度下平衡时体系中CO2转化率和CH3OH(或CO)选择性如图2所示。
=1:3的混合气体置于密闭容器中反应,不同温度下平衡时体系中CO2转化率和CH3OH(或CO)选择性如图2所示。
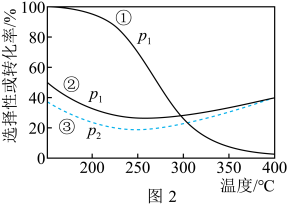
已知:CH3OH(或CO)的选择性= ×100%
×100%
①曲线①代表的是______ 的选择性曲线(填“CH3OH”或“CO”)。
②p1______ p2(选填“=”、“>”或“<”)。
③温度高于250℃,曲线②或曲线③上升的原因是______ 。
(1)利用工业废气中的CO2可制取甲醇,其反应为CO2(g)+3H2(g)
(2)电化学法将CO2转化为甲酸。科学家近年发明了一种新型Zn-CO2水介质电池。如图1所示,电极分别为金属铈和选择性催化材料,放电时,CO2被转化为储氢物质甲酸。注:双极隔膜为一层阳离子交换膜和一层阴离子交换膜复合而成,中间为水,作为电解质溶液中H+和OH-的来源。

①放电时,正极电极反应式为
②与Zn极室相连的离子交换膜为
(3)热化学法将CO2转化为甲醇。CO2催化加氢主要反应有:
反应I.CO2(g)+3H2(g)
反应Ⅱ.CO2(g)+H2(g)
压强分别为p1、p2时,将

已知:CH3OH(或CO)的选择性=
①曲线①代表的是
②p1
③温度高于250℃,曲线②或曲线③上升的原因是
23-24高二上·福建三明·阶段练习
类题推荐
I. 的资源化利用是实现碳中和的重要途径。电化学法将
的资源化利用是实现碳中和的重要途径。电化学法将 转化为甲酸科学家近年发明了一种新型
转化为甲酸科学家近年发明了一种新型 水介质电池。如图所示,电极分别为金属锌和选择性催化材料,放电时,
水介质电池。如图所示,电极分别为金属锌和选择性催化材料,放电时, 被转化为储氢物质甲酸。
被转化为储氢物质甲酸。 和
和 的来源。
的来源。
(1)放电时,正极电极反应式为_______ 。
(2)充电时每生成 ,理论上阴极获
,理论上阴极获 的物质的量为
的物质的量为_______ 。
(3)与 极室相连的为
极室相连的为_______ 离子交换膜 (填“阴”或“阳”)。
Ⅱ.甲醇气相脱水制甲醚的反应可表示为 ,
,
请回答下列问题:
(4)一定温度下,在恒容密闭容器中充入一定量的 发生上述反应,能判断反应达到化学平衡状态的是_______。
发生上述反应,能判断反应达到化学平衡状态的是_______。
(5) 时,向恒容密闭容器中充入一定量的
时,向恒容密闭容器中充入一定量的 发生上述反应,测得
发生上述反应,测得 的浓度随时间(t)的变化如下表:
的浓度随时间(t)的变化如下表:
① 内,用
内,用 表示该反应的平均速率为
表示该反应的平均速率为_______ 。
② 的平衡转化率为
的平衡转化率为_______ 。
③ 时,向该容器中投入三种成分的浓度如下:
时,向该容器中投入三种成分的浓度如下:
该时刻,正、逆反应速率的大小关系为
_____  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
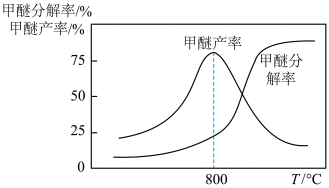
(6)已知:甲醚在一定条件下可分解为 和
和 ,甲醚分解率、甲醇脱水制甲醚产率随温度变化关系如图所示试解释
,甲醚分解率、甲醇脱水制甲醚产率随温度变化关系如图所示试解释 之后甲醇脱水制甲醚产率降低的原因为
之后甲醇脱水制甲醚产率降低的原因为_______ 。

(1)放电时,正极电极反应式为
(2)充电时每生成
(3)与
Ⅱ.甲醇气相脱水制甲醚的反应可表示为
请回答下列问题:
(4)一定温度下,在恒容密闭容器中充入一定量的
| A. |
| B. |
| C.容器内压强不再变化 |
| D.混合气体的平均相对分子质量不再变化 |
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | |
| 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
②
③
| 物质 | |||
| 0.54 | 0.68 | 0.68 |
(6)已知:甲醚在一定条件下可分解为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网