解答题-原理综合题 较难0.4 引用1 组卷630
Ⅰ.在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2混合气体,2 min后,反应达到平衡,生成SO3气体0.5 mol,同时放出热量Q kJ。回答下列问题
(1)写出该反应的热化学方程式为___________ 。
(2)在该条件下,反应前后容器的体积之比为___________ 。
(3)①若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)___________ 0.5mol(填 “大于”、“小于”或“等于”);
②若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量___________ Q kJ(填 “大于”、“小于”或“等于”)。
Ⅱ. 用焦炭还原NO2的反应为:2NO2(g)+2C(s ) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
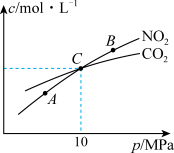
(4)A、B两点的浓度平衡常数关系:Kc(A)___________ Kc(B) (填 “﹥”、“<”或“﹦”)。
(5)A、B、C三点中NO2的转化率最高的是___________ (填“A”或“B”或“C”)点。
(6)计算C点时该反应的压强平衡常数Kp(C)=___________ (Kp是用平衡分压代替平衡浓度计算,分压=总压物质的量分数)。
Ⅲ.25℃时,向10mL0.1mol•L-1NH4HSO4溶液中逐滴滴入0.1mol•L-1NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:
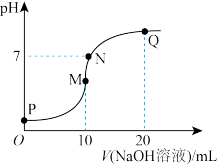
(7)M、Q两点中,水的电离程度较大的是___________ 点。
(8)下列关系中,正确的是___________ 。
a.M点c(Na+)>c(NH )
)
b.N点c(NH )+c(Na+)=2c(SO
)+c(Na+)=2c(SO )
)
c.Q点c(NH )+c(NH3•H2O)=c(Na+)
)+c(NH3•H2O)=c(Na+)
(1)写出该反应的热化学方程式为
(2)在该条件下,反应前后容器的体积之比为
(3)①若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)
②若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量
Ⅱ. 用焦炭还原NO2的反应为:2NO2(g)+2C(s )

(4)A、B两点的浓度平衡常数关系:Kc(A)
(5)A、B、C三点中NO2的转化率最高的是
(6)计算C点时该反应的压强平衡常数Kp(C)=
Ⅲ.25℃时,向10mL0.1mol•L-1NH4HSO4溶液中逐滴滴入0.1mol•L-1NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:

(7)M、Q两点中,水的电离程度较大的是
(8)下列关系中,正确的是
a.M点c(Na+)>c(NH
b.N点c(NH
c.Q点c(NH
22-23高二上·湖北襄阳·期末
类题推荐
氮的化合物在生产、生活中广泛存在
(1)键能是气态原子形成1mol化学键释放的最低能量。已知下列化学键的键能如表所示,写出1mol气态肼(NH2-NH2)燃烧生成氮气和水蒸气的热化学方程式_________
(2)用焦炭还原NO的反应为:2NO(g)+C(s)  N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
该反应为_____________ (填“放热”或“吸热”)反应乙容器中的反应在60min时达到平衡状态,则0-60min内用NO的浓度变化表示的平均反应速率V(NO)=_________
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
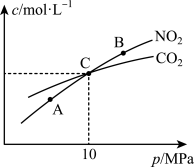
①A、B两点的浓度平衡常数关系:Kc(A)_____________ Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是_____________ (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=____________ (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)键能是气态原子形成1mol化学键释放的最低能量。已知下列化学键的键能如表所示,写出1mol气态肼(NH2-NH2)燃烧生成氮气和水蒸气的热化学方程式
| 化学键 | N≡N | O=O | N-N | N-H | O-H |
| 键能/(kJ/mol) | 946 | 497 | 193 | 391 | 463 |
| t/min | 0 | 10 | 20 | 30 | 40 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
该反应为
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)

①A、B两点的浓度平衡常数关系:Kc(A)
②A、B、C三点中NO2的转化率最高的是
③计算C点时该反应的压强平衡常数Kp(C)=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网