解答题-原理综合题 适中0.65 引用4 组卷349
氮氧化物是形成酸雨和光化学烟雾的主要物质之一。研究消除氮氧化物的反应机理,对建设生态文明、美丽中国具有重要意义。回答下列问题:
(1)NO2是工业合成硝酸的中间产物,也是一种主要的大气污染物,工业可采用CH4消除NO2污染,主要原理为CH4(g)+2NO2(g) CO2(g)+2H2O(g)+N2(g) △H。
CO2(g)+2H2O(g)+N2(g) △H。
①已知:CH4的燃烧热△H1=-890.3kJ•mol-1
N2(g)+2O2(g)=2NO2(g) △H2=+133kJ•mol-1
H2O(g)=H2O(l) △H3=-44kJ•mol-1
则△H=________ kJ•mol-1。
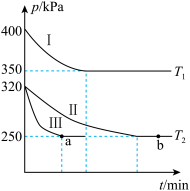
②在3.0L恒温密闭容器中通入1molCH4和2molNO2,进行上述反应,容器内气体总压强(p)随反应时间(t)变化的数据如表所示:
则0~4min用NO2表示该反应的平均速率v(NO2)=________ mol/(L•min),该温度下的平衡常数Kp=_________ kPa。
(2)N2O曾用作麻醉剂,其分解的方程式为2N2O(g) 2N2(g)+O2(g),分别向四个密闭容器中充入如表所示相应气体,进行上述反应。容器I、II、III中N2O的平衡转化率随温度变化的曲线如图所示:
2N2(g)+O2(g),分别向四个密闭容器中充入如表所示相应气体,进行上述反应。容器I、II、III中N2O的平衡转化率随温度变化的曲线如图所示:
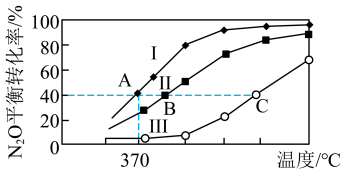
①若容器IV保持370℃,则起始反应速率v正(N2O)_______ 2v逆(O2)(填“>”“<”或“=”)。
②A、B、C三点中压强最大的是_______ 。
③碘蒸气的存在能大幅度提高N2O的分解速率,反应历程如下:
第一步I2(g) 2I(g)(快速平衡,平衡常数为K)
2I(g)(快速平衡,平衡常数为K)
第二步I(g)+N2O(g) N2(g)+IO(g)(慢反应)
N2(g)+IO(g)(慢反应)
第三步2IO(g)+2N2O(g) 2N2(g)+2O2(g)+I2(g)(快反应)
2N2(g)+2O2(g)+I2(g)(快反应)
则第二步的活化能________ (填“>”“<”或“=”)第三步的活化能。
实验表明,碘蒸气存在时N2O分解速率方程v=k•c(N2O)•c0.5(I2)(k为速率常数),已知第二步反应不影响第一步的平衡,其反应速率方程v=k1•c(N2O)•c(I)(k1为速率常数)。则第一步反应的平衡常数K=________ (用k和k1表示)。
(1)NO2是工业合成硝酸的中间产物,也是一种主要的大气污染物,工业可采用CH4消除NO2污染,主要原理为CH4(g)+2NO2(g)
①已知:CH4的燃烧热△H1=-890.3kJ•mol-1
N2(g)+2O2(g)=2NO2(g) △H2=+133kJ•mol-1
H2O(g)=H2O(l) △H3=-44kJ•mol-1
则△H=
②在3.0L恒温密闭容器中通入1molCH4和2molNO2,进行上述反应,容器内气体总压强(p)随反应时间(t)变化的数据如表所示:
| 反应时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强p/×100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
(2)N2O曾用作麻醉剂,其分解的方程式为2N2O(g)

| 容器 | 物质的量/mol | |||
| 编号 | 体积/L | N2O | N2 | O2 |
| I | V1=1.0 | 0.1 | 0 | 0 |
| II | V2 | 0.1 | 0 | 0 |
| III | V3 | 0.1 | 0 | 0 |
| IV | V4=1.0 | 0.06 | 0.04 | 0.04 |
②A、B、C三点中压强最大的是
③碘蒸气的存在能大幅度提高N2O的分解速率,反应历程如下:
第一步I2(g)
第二步I(g)+N2O(g)
第三步2IO(g)+2N2O(g)
则第二步的活化能
实验表明,碘蒸气存在时N2O分解速率方程v=k•c(N2O)•c0.5(I2)(k为速率常数),已知第二步反应不影响第一步的平衡,其反应速率方程v=k1•c(N2O)•c(I)(k1为速率常数)。则第一步反应的平衡常数K=
23-24高三上·广东广州·阶段练习
类题推荐
回答下列问题。
(1)NO2是工业合成硝酸的中间产物,也是一种主要的大气污染物,工业可采用CH4消除NO2污染,主要原理为CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g) ΔH1。
①已知:CH4的燃烧热为890.3kJ/mol;N2(g)+2O2(g)=2NO2(g) ΔH2=+133kJ/mol;H2O(g)=H2O(l) ΔH3=-44kJ/mol,则ΔH1=_______ kJ/mol。
②在3.0L恒温密闭容器中通入1molCH4和2molNO2进行上述反应,容器内气体总压强(p)随反应时间(t)变化的数据如表所示:
则0~8min用NO2表示该反应的平均速率v(NO2)=_______ mol/(L•min),该温度下的平衡常数Kp=_______ kPa。
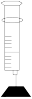
(2)室温下,用注射器吸入一定量NO2气体,将针头插入胶塞密封(如图),然后迅速将气体体积压缩为原来的一半并使活塞固定,此时手握针筒有热感,继续放置一段时间。从活塞固定时开始观察,气体颜色逐渐_______ (填“变深”或“变浅”),原因是_______ 。[已知2NO2(g)═N2O4(g)在几微秒内即可达到化学平衡]
(3)N2O曾用作麻醉剂,其分解方程式为2N2O(g) 2N2(g)+O2(g),分别向四个密闭容器中充入如表所示相应气体,进行上述反应。容器I、Ⅱ、Ⅲ中N2O的平衡转化率随温度变化的曲线如图所示:
2N2(g)+O2(g),分别向四个密闭容器中充入如表所示相应气体,进行上述反应。容器I、Ⅱ、Ⅲ中N2O的平衡转化率随温度变化的曲线如图所示:

①若容器Ⅳ保持370℃,则起始反应速率v正(N2O)_______ 2v逆(O2)(填“>”<”或“=”)。
②A、B、C三点中压强最大的是_______ 。
(1)NO2是工业合成硝酸的中间产物,也是一种主要的大气污染物,工业可采用CH4消除NO2污染,主要原理为CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g) ΔH1。
①已知:CH4的燃烧热为890.3kJ/mol;N2(g)+2O2(g)=2NO2(g) ΔH2=+133kJ/mol;H2O(g)=H2O(l) ΔH3=-44kJ/mol,则ΔH1=
②在3.0L恒温密闭容器中通入1molCH4和2molNO2进行上述反应,容器内气体总压强(p)随反应时间(t)变化的数据如表所示:
| 反应时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强p/×100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
(2)室温下,用注射器吸入一定量NO2气体,将针头插入胶塞密封(如图),然后迅速将气体体积压缩为原来的一半并使活塞固定,此时手握针筒有热感,继续放置一段时间。从活塞固定时开始观察,气体颜色逐渐

(3)N2O曾用作麻醉剂,其分解方程式为2N2O(g)

| 容器 | 物质的量/mol | |||
| 编号 | 体积/L | N2O | N2 | O2 |
| I | V1=1.0 | 0.1 | 0 | 0 |
| Ⅱ | V2 | 0.1 | 0 | 0 |
| Ⅲ | V3 | 0.1 | 0 | 0 |
| Ⅳ | V4=1.0 | 0.06 | 0.06 | 0.04 |
②A、B、C三点中压强最大的是
I.汽车尾气中的NO(g)和CO(g)在一定条件下可发生反应生成无毒的N2和CO2。
(1)已知:①N2(g)+O2(g)⇌2NO(g) ΔH1= +180.5 kJ·mol-1,
②CO的燃烧热ΔH2=-283.0 kJ·mol-l,
则反应③2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ΔH3=______ 。
(2)南宁三中化学研究小组在三个容积为5 L的恒容密闭容器中,分别充入0.4 mol NO和0.4 mol CO,发生反应③。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示:
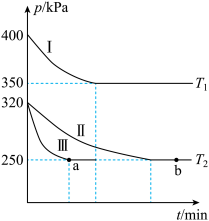
①温度:T1______ T2(填“<”“=”或“>”)。
②CO的平衡转化率:Ⅰ______ Ⅱ______ Ⅲ(填“<”“=”或“>”)。
③T2时的平衡常数K=______ 。(列出计算式)
Ⅱ.氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。
(1)在一定温度下的恒容容器中,反应2N2O(g)⇌2N2(g)+O2(g)的部分实验数据如下:
①在0~20 min,反应速率v(O2)为______ mol·L-1·min-1。
②若N2O起始浓度c0为0.150 mol·L-1,则反应至30 min时N2O的转化率α=______ 。
③该反应达到平衡的标志有______
a.混合气体的密度保持不变
b.混合气体的平均摩尔质量保持不变
c.v正(N2O):v逆(O2) = 2:1
d.c(N2O):c(N2):c(O2) = 2:2:1
e.单位时间内有1 mol O=O键断裂同时有2 mol N≡N形成
(2)碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)⇌2I(g) (快速平衡,平衡常数为K)
第二步I(g)+N2O(g)⇌N2(g)+IO(g) (慢反应,v=k1·c(N2O)·c(I),k1为速率常数)
第三步IO(g)+N2O(g)⇌N2(g)+O2(g)+I(g) (快反应)
①其中可近似认为第二步反应不影响第一步的平衡。实验表明,含碘时N2O分解速率方程v=k2·c(N2O)·[c(I2)]0.5(k2为速率常数)。下列表述正确的是______ (填标号)。
a.第一步对总反应速率起决定作用
b.第二步活化能比第三步大
c.I2浓度与N2O分解速率无关
d.催化剂会降低反应的活化能,从而影响△H
②若第二步反应的速率等于N2O分解的总反应速率,则k2=______ (用含K和k1的代数式表示)
(1)已知:①N2(g)+O2(g)⇌2NO(g) ΔH1= +180.5 kJ·mol-1,
②CO的燃烧热ΔH2=-283.0 kJ·mol-l,
则反应③2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ΔH3=
(2)南宁三中化学研究小组在三个容积为5 L的恒容密闭容器中,分别充入0.4 mol NO和0.4 mol CO,发生反应③。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示:

①温度:T1
②CO的平衡转化率:Ⅰ
③T2时的平衡常数K=
Ⅱ.氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。
(1)在一定温度下的恒容容器中,反应2N2O(g)⇌2N2(g)+O2(g)的部分实验数据如下:
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| c(N2O)/mol/L | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.010 |
①在0~20 min,反应速率v(O2)为
②若N2O起始浓度c0为0.150 mol·L-1,则反应至30 min时N2O的转化率α=
③该反应达到平衡的标志有
a.混合气体的密度保持不变
b.混合气体的平均摩尔质量保持不变
c.v正(N2O):v逆(O2) = 2:1
d.c(N2O):c(N2):c(O2) = 2:2:1
e.单位时间内有1 mol O=O键断裂同时有2 mol N≡N形成
(2)碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)⇌2I(g) (快速平衡,平衡常数为K)
第二步I(g)+N2O(g)⇌N2(g)+IO(g) (慢反应,v=k1·c(N2O)·c(I),k1为速率常数)
第三步IO(g)+N2O(g)⇌N2(g)+O2(g)+I(g) (快反应)
①其中可近似认为第二步反应不影响第一步的平衡。实验表明,含碘时N2O分解速率方程v=k2·c(N2O)·[c(I2)]0.5(k2为速率常数)。下列表述正确的是
a.第一步对总反应速率起决定作用
b.第二步活化能比第三步大
c.I2浓度与N2O分解速率无关
d.催化剂会降低反应的活化能,从而影响△H
②若第二步反应的速率等于N2O分解的总反应速率,则k2=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网