解答题-原理综合题 较难0.4 引用1 组卷146
CO2的转化和利用是实现碳中和的有效途径。其中CO2转换为CH3OH被认为是最可能利用的路径,该路径涉及反应如下:
反应I:
反应Ⅱ:
请回答下列问题:
(1)若已知H2和CO的燃烧热,计算反应Ⅱ的 H2,还需要的一个数据为
H2,还需要的一个数据为_______ 。
(2)在催化剂条件下,反应I的反应机理和相对能量变化如图(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
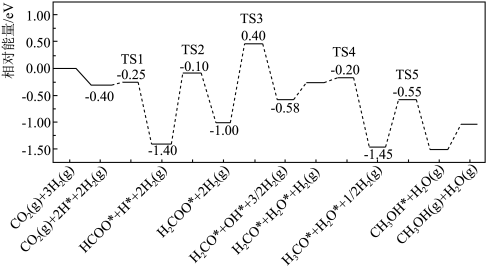
完善该反应机理中相关的化学反应方程式:
_______ ;以TS2为过渡态的反应,其正反应活化能为_______ eV。
(3)在恒温恒压下,CO2和H2按体积比1:3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如表。
已知:①分子筛膜催化反应器(B)具有催化反应、分离出部分水蒸气的双重功能;
②CH3OH的选择性
①在普通反应器(A)中,下列不能作为反应(反应I和反应Ⅱ)达到平衡状态的判据是_______ (填标号)。
A.气体的密度不再变化 B.气体的压强不再改变
C.v正(CO2)=3v逆(H2) D.各物质浓度比不再改变
②平衡状态下,反应器(A)中,甲醇的选择性随温度升高而降低,可能的原因是_______ 。
③在反应器(B)中,CO2的平衡转化率明显高于反应器(A),可能的原因是_______ 。
④若反应器(A)中初始时n(CO2)=1mol,反应Ⅱ的化学平衡常数Kp(Ⅱ)=_______ (用最简的分数表示)。
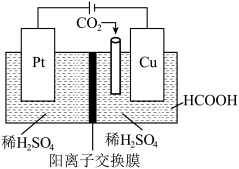
(4)近年来,有研究人员用CO2通过电催化生成HCOOH,实现CO2的回收利用,其工作原理如图所示。请写出Cu电极上的电极反应式:_______ 。
反应I:
反应Ⅱ:
请回答下列问题:
(1)若已知H2和CO的燃烧热,计算反应Ⅱ的
(2)在催化剂条件下,反应I的反应机理和相对能量变化如图(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。

完善该反应机理中相关的化学反应方程式:
(3)在恒温恒压下,CO2和H2按体积比1:3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如表。
已知:①分子筛膜催化反应器(B)具有催化反应、分离出部分水蒸气的双重功能;
②CH3OH的选择性
| 1.8MPa 260℃ | |||
| CO2平衡转化率 | 甲醇的选择性 | 达到平衡时间(s) | |
| 普通反应器(A) | 25.0% | 80.0% | 10.0 |
| 分子筛膜催化反应器(B) | a>25.0% | 100.0% | 8.0 |
A.气体的密度不再变化 B.气体的压强不再改变
C.v正(CO2)=3v逆(H2) D.各物质浓度比不再改变
②平衡状态下,反应器(A)中,甲醇的选择性随温度升高而降低,可能的原因是
③在反应器(B)中,CO2的平衡转化率明显高于反应器(A),可能的原因是
④若反应器(A)中初始时n(CO2)=1mol,反应Ⅱ的化学平衡常数Kp(Ⅱ)=
(4)近年来,有研究人员用CO2通过电催化生成HCOOH,实现CO2的回收利用,其工作原理如图所示。请写出Cu电极上的电极反应式:

23-24高三上·山西运城·阶段练习
类题推荐  .
. 的转化和利用是实现碳中和的有效途径。
的转化和利用是实现碳中和的有效途径。
(1)在298K、100kPa时,已知:
C(s,石墨)





在298K时由C(s,石墨)和 (g)反应生成1mol
(g)反应生成1mol  (g)的热化学方程式为
(g)的热化学方程式为___________ 。
 .
. 转化为
转化为 被认为是实现最可能利用的路径,该路径涉及反应如下:
被认为是实现最可能利用的路径,该路径涉及反应如下:
主反应:

副反应:

(2)工业合成甲醇通常控制温度为400℃左右,请从反应速率与化学平衡的角度分析其主要原因是___________ 。
(3)在恒温恒压(1.8MPa,400℃)下, 和
和 按体积比1∶3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如下表。
按体积比1∶3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如下表。
已知:i.分子筛膜催化反应器(B)具有催化反应、分离出部分水蒸气的双重功能;
ii. 的选择性=
的选择性= 。
。
①在普通反应器(A)中,下列能作为反应(主反应和副反应)达到平衡状态的判据是___________ (填序号)。
A.气体压强不再变化 B.气体的密度不再改变
C. D.各物质浓度比不再改变
D.各物质浓度比不再改变
②在反应器(B)中, 的平衡转化率明显高于反应器(A),可能的原因是
的平衡转化率明显高于反应器(A),可能的原因是___________ 。
③若普通反应器(A)中初始时 ,主反应从开始到平衡态的平均反应速率
,主反应从开始到平衡态的平均反应速率
___________  ;副反应的化学平衡常数
;副反应的化学平衡常数
___________ (用最简的分数表示)。
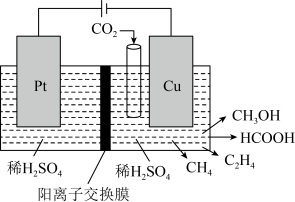
 .近年来,有研究人员用
.近年来,有研究人员用 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示。
的回收利用,其工作原理如图所示。___________ ;若Cu电极上只生成0.15mol  和0.3mol
和0.3mol  ,则Pt电极上产生
,则Pt电极上产生 的物质的量
的物质的量___________ mol。
(1)在298K、100kPa时,已知:
C(s,石墨)
在298K时由C(s,石墨)和
主反应:
副反应:
(2)工业合成甲醇通常控制温度为400℃左右,请从反应速率与化学平衡的角度分析其主要原因是
(3)在恒温恒压(1.8MPa,400℃)下,
| 反应器 | 甲醇的选择性 | 达到平衡时间/s | |
| 普通反应器(A) | 25.0% | 80.0% | 10.0 |
| 分子筛膜催化反应器(B) | a>25.0% | 100.0% | 8.0 |
ii.
①在普通反应器(A)中,下列能作为反应(主反应和副反应)达到平衡状态的判据是
A.气体压强不再变化 B.气体的密度不再改变
C.
②在反应器(B)中,
③若普通反应器(A)中初始时
甲醇和乙醇是可再生能源,具有广泛的发展前景。回答下列问题:
(1) 催化氧化可制得
催化氧化可制得 。主要反应为:
。主要反应为:
反应I:
 ;
;
反应Ⅱ:
 。
。
还可能发生下列副反应:
反应Ⅲ:
 ;
;
反应Ⅳ:
 ;
;
反应V:
 。
。
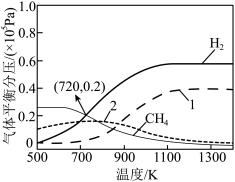
研究发现,在实验条件下,乙醇的转化率均接近100%。 下,氧醇比为0.6时,部分气体产物(
下,氧醇比为0.6时,部分气体产物( 、CO、
、CO、 和
和 )的平衡分压p[
)的平衡分压p[ ]随温度的变化如图所示(已知:用气体物质的分压替换浓度计算得到的平衡常数称为分压平衡常数
]随温度的变化如图所示(已知:用气体物质的分压替换浓度计算得到的平衡常数称为分压平衡常数 )。
)。
①反应 的
的
___________ 。
②图中___________ (填“曲线1”或“曲线2”)表示CO的平衡分压随温度的变化。
③720K时,反应Ⅳ的
___________ ;积碳会覆盖固体催化剂的活性点位,使固体催化剂的活性降低,从1000K开始继续升高温度,固体催化剂的活性先增强后减弱的原因是___________ 。
(2) 和
和 合成甲醇。反应为
合成甲醇。反应为
 。在恒温恒压条件下,
。在恒温恒压条件下, 和
和 按体积比1∶3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如下表。
按体积比1∶3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如下表。
已知:
i.分子筛膜催化反应器(B)具有催化作用、分离出部分水蒸气的双重功能;
ii. 的选择性
的选择性 。
。
①在普通反应器(A)中,下列能作为上述反应达到平衡状态的判据是___________ (填字母)。
A.气体压强不再改变 B.气体的密度不再改变
C. D.各物质浓度比不再改变
D.各物质浓度比不再改变
②在反应器(B)中, 的平衡转化率明显高于反应器(A),原因可能是
的平衡转化率明显高于反应器(A),原因可能是___________ 。
(1)
反应I:
反应Ⅱ:
还可能发生下列副反应:
反应Ⅲ:
反应Ⅳ:
反应V:
研究发现,在实验条件下,乙醇的转化率均接近100%。

①反应
②图中
③720K时,反应Ⅳ的
(2)
| 反应器 | 1.8MPa260℃ | ||
| 甲醇的选择性 | 达到平衡时间是(s) | ||
| 普通反应器(A) | 25.0% | 80.0% | 10.0 |
| 分子筛膜催化反应器(B) | a>25.0% | 100.0% | 8.0 |
i.分子筛膜催化反应器(B)具有催化作用、分离出部分水蒸气的双重功能;
ii.
①在普通反应器(A)中,下列能作为上述反应达到平衡状态的判据是
A.气体压强不再改变 B.气体的密度不再改变
C.
②在反应器(B)中,
研发二氧化碳的碳捕集和碳利用技术是科学研究热点问题,其中催化转化法最具应用价值。回答下列问题:
(1)常温常压下,一些常见物质的燃烧热如表所示。
已知:
 。
。
则

_______________  ,该反应中活化能:
,该反应中活化能: (正)
(正)_______________  (逆)(填“高于”“等于”或“低于”)。
(逆)(填“高于”“等于”或“低于”)。
(2)在氢气还原 的催化反应中,
的催化反应中, 可被催化转化为甲醇,同时有副产物
可被催化转化为甲醇,同时有副产物 生成,为了提高甲醇的选择性,某科研团队研制了一种具有反应和分离双功能的分子筛膜催化反应器,原理如图所示。
生成,为了提高甲醇的选择性,某科研团队研制了一种具有反应和分离双功能的分子筛膜催化反应器,原理如图所示。
保持压强为3MPa,温度为260℃,向密闭容器中按投料比 投入一定量
投入一定量 和
和 ,不同反应模式下
,不同反应模式下 的平衡转化率和甲醇的选择性的相关实验数据如下表所示。
的平衡转化率和甲醇的选择性的相关实验数据如下表所示。
①恒温恒容条件下,分子筛膜催化反应器模式中,发生反应 ,下列说法能作为此反应达到平衡状态的判断依据的是
,下列说法能作为此反应达到平衡状态的判断依据的是_________________ (填字母)。
A.气体压强不再变化
B.气体的密度不再改变
C.
D.
②由表中数据可知双功能的分子筛膜催化反应器模式下, 的转化率明显提高,结合具体反应分析可能的原因:
的转化率明显提高,结合具体反应分析可能的原因:_________________ 。
(3)一定条件下使 、
、 混合气体通过反应器,检测反应器出口气体的成分及其含量,计算
混合气体通过反应器,检测反应器出口气体的成分及其含量,计算 的转化率和
的转化率和 的选择性以评价催化剂的性能。
的选择性以评价催化剂的性能。
已知:I.反应器内发生的反应有:
a.
 ;
;
b.
 。
。
Ⅱ. 选择性
选择性 。
。
①220℃时,测得反应器出口气体中全部含碳物质的物质的量之比
 ,则该温度下
,则该温度下 转化率=
转化率=_________________  (列出计算式即可,无需化简)。
(列出计算式即可,无需化简)。
②其他条件相同时,反应温度对 的转化率和
的转化率和 的选择性的影响如下图所示。
的选择性的影响如下图所示。

温度高于260℃时, 平衡转化率变化的原因是
平衡转化率变化的原因是___________________ 。
③由②中图像可知,温度相同时, 选择性的实验值略高于平衡值,从化学反应速率角度分析,在该条件下,温度低于240℃时,反应a和反应b的速率之比相同条件下平衡时
选择性的实验值略高于平衡值,从化学反应速率角度分析,在该条件下,温度低于240℃时,反应a和反应b的速率之比相同条件下平衡时 和甲醇的物质的量之比
和甲醇的物质的量之比___________________ (填“>”“<”或“=”)1。
(4)近年来,有研究人员用 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示。
的回收利用,其工作原理如图所示。
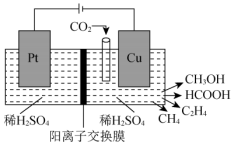
写出 电极上产生
电极上产生 的电极反应式:
的电极反应式:___________________ 。
(1)常温常压下,一些常见物质的燃烧热如表所示。
名称 | 氢气 | 甲烷 | 一氧化碳 | 甲醇 |
化学式 | ||||
-285.8 | -890.3 | -283.0 | -726.5 |
则
(2)在氢气还原

保持压强为3MPa,温度为260℃,向密闭容器中按投料比
| 实验 | 反应模式 | 温度/℃ | |||
| ① | 普通催化反应器 | 3 | 260 | 21.9 | 67.3 |
| ② | 分子筛膜催化反应器 | 3 | 260 | 36.1 | 100 |
A.气体压强不再变化
B.气体的密度不再改变
C.
D.
②由表中数据可知双功能的分子筛膜催化反应器模式下,
(3)一定条件下使
已知:I.反应器内发生的反应有:
a.
b.
Ⅱ.
①220℃时,测得反应器出口气体中全部含碳物质的物质的量之比
②其他条件相同时,反应温度对

温度高于260℃时,
③由②中图像可知,温度相同时,
(4)近年来,有研究人员用

写出
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


