解答题-实验探究题 适中0.65 引用4 组卷148
KI可用作制有机化合物及制药原料,医疗上用于防治甲状腺肿和甲状腺功能亢进的手术前准备所需药物,也可用作祛痰药。某实验小组设计制备一定量KI的实验(加热及夹持装置已省略)如下:
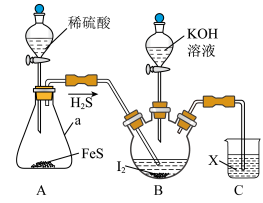
(1)实验开始前,先进行的操作为_______ 。
(2)仪器a的名称是_______ 。
(3)实验中不能用稀硝酸代替稀硫酸的根本原因是_______ 。
(4)久置KI溶液易被氧化而导致变质,实验小组取久置KI溶液进行实验,如图所示。
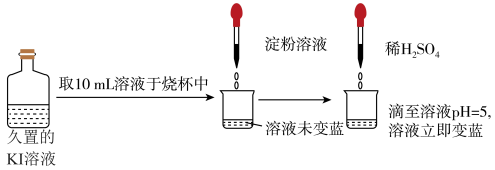
关于溶液立即变蓝的原因,该实验小组进行了如下探究,请将空格补充完整:
①提出猜想
猜想Ⅰ.酸性条件下,空气中的O2将I-迅速氧化成I2;
猜想Ⅱ.KI溶液久置过程中产生了 ;
; 在酸性条件下与I-反应生成I2。
在酸性条件下与I-反应生成I2。
②实验与结论
(5)测定KI的纯度:称取0.5000g样品溶于水,加入稍过量硫酸酸化的H2O2充分反应后,加热除去过量H2O2,加入几滴淀粉溶液,用0.2000mol·L-1的Na2S2O3标准溶液滴定( )。
)。
①滴定前装有标准液的滴定管排气泡时,应选择图中的_______ (填标号,下同)。
a. b.
b. c.
c.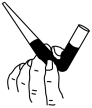 d.
d.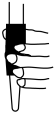
②若用25.00ml的滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积_______ 。
a.=10.00mL b.=15.00mL c.<10.00mL d.>15.00mL
③滴定终点时消耗14.50mL标准溶液,则样品的纯度为_______ (计算结果保留两位有效数字)。

(1)实验开始前,先进行的操作为
(2)仪器a的名称是
(3)实验中不能用稀硝酸代替稀硫酸的根本原因是
(4)久置KI溶液易被氧化而导致变质,实验小组取久置KI溶液进行实验,如图所示。

关于溶液立即变蓝的原因,该实验小组进行了如下探究,请将空格补充完整:
①提出猜想
猜想Ⅰ.酸性条件下,空气中的O2将I-迅速氧化成I2;
猜想Ⅱ.KI溶液久置过程中产生了
②实验与结论
| 实验编号 | 实验方案 | 实验现象 | 结论与解释 |
| ⅰ | 往试管中加入10mL0.1mol·L-1新制KI溶液并加入几滴淀粉溶液, | 50min后溶液变蓝 | 猜想Ⅰ不成立 |
| ⅱ | 取少量KIO3溶液与少量KI溶液混合,加入淀粉溶液,再滴加稀H2SO4调节pH至5 | 溶液立即变蓝 | 猜想Ⅱ成立。写出相关反应的离子方程式 |
①滴定前装有标准液的滴定管排气泡时,应选择图中的
a.
 b.
b. c.
c. d.
d.
②若用25.00ml的滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积
a.=10.00mL b.=15.00mL c.<10.00mL d.>15.00mL
③滴定终点时消耗14.50mL标准溶液,则样品的纯度为
23-24高三上·重庆·阶段练习
类题推荐
碘化钾用作制有机物及制药原料,医疗上用于防治甲状腺肿大,作祛痰药,还可用于照相制版等。实验小组设计实验制备KI并探究相关性质。
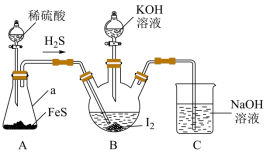
(一)制备KI
某实验小组设计制备一定量KI的实验(加热及夹持装置已省略)如图:
反应I:
反应Ⅱ:
(1)实验开始前,先进行装置气密性检查:将C中导管下端管口浸入液面以下,塞紧瓶塞,微热A装置,若___________ ,则气密性良好。
(2)在装置B中先滴入KOH溶液,待观察到三颈烧瓶中溶液颜色由___________ 色变为___________ 色,停止滴入KOH溶液;然后打开装置A中分液漏斗活塞,待三颈烧瓶和烧杯中产生气泡的速率接近相等时停止通气,反应完成。
(3)请用离子方程式解释C中NaOH溶液的作用___________________________ 。
(4)装置B中所得KI溶液经分离提纯后得到KI粗产品,为测定KI的纯度,称取2.0g样品溶于水,然后用0.1000mol·L-1酸性KMnO4标准溶液滴定( ),杂质不与酸性KMnO4溶液反应。平行滴定三次,滴定到终点平均消耗酸性KMnO4标准溶液22.00mL,则样品的纯度为
),杂质不与酸性KMnO4溶液反应。平行滴定三次,滴定到终点平均消耗酸性KMnO4标准溶液22.00mL,则样品的纯度为___________ (保留两位有效数字)。
(二)实验探究:FeCl3与KI的反应
(5)证明实验I中有碘单质生成,可以加入___________ 检验。
(6)已知在酸性较强的条件下,I-可被空气氧化为I2,为探究实验I中20min后棕黄色变深的原因,甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验I中溶液棕黄色变深。甲同学设计的实验为:___________ ,若20min后溶液不变蓝,证明该假设不成立。(可选试剂:0.1mol·L-1KI溶液、0.1mol·L-1FeCl3溶液、淀粉溶液、稀硫酸)

(一)制备KI
某实验小组设计制备一定量KI的实验(加热及夹持装置已省略)如图:
反应I:
反应Ⅱ:
(1)实验开始前,先进行装置气密性检查:将C中导管下端管口浸入液面以下,塞紧瓶塞,微热A装置,若
(2)在装置B中先滴入KOH溶液,待观察到三颈烧瓶中溶液颜色由
(3)请用离子方程式解释C中NaOH溶液的作用
(4)装置B中所得KI溶液经分离提纯后得到KI粗产品,为测定KI的纯度,称取2.0g样品溶于水,然后用0.1000mol·L-1酸性KMnO4标准溶液滴定(
(二)实验探究:FeCl3与KI的反应
序号 | 操作 | 现象 |
实验I | 取5mL0.1mol·L-1KI溶液,滴加0.1mol·L-1 FeCl3溶液5~6滴(混合溶液的pH=5) | 溶液变为棕黄色,20min后棕黄色变深 |
实验Ⅱ | 取少量实验I中棕黄色溶液于试管中,滴加2滴KSCN溶液 | 溶液变红,20min后红色变浅 |
(6)已知在酸性较强的条件下,I-可被空气氧化为I2,为探究实验I中20min后棕黄色变深的原因,甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验I中溶液棕黄色变深。甲同学设计的实验为:
碘化钾用作制有机物及制药原料,医疗上用于防治甲状腺肿大,作祛痰药,还可用于照相制版等。实验小组设计实验制备KI并探究相关性质。
(一)制备KI
某实验小组设计制备一定量KI的实验(加热及夹持装置已省略)如下:
反应I:
反应Ⅱ:
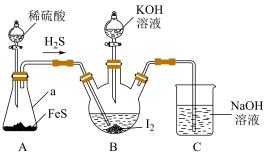
(1)实验开始前,先进行装置气密性检查:将C中导管下端管口浸入液面以下,塞紧瓶塞,微热A装置,若___________ ,则气密性良好。
(2)在装置B中先滴入KOH溶液,待观察到三颈烧瓶中溶液颜色由___________ 色变为___________ 色,停止滴入KOH溶液;然后打开装置A中分液漏斗活塞,待三颈烧瓶和烧杯中产生气泡的速率接近相等时停止通气,反应完成。
(3)实验中不能用稀硝酸代替稀硫酸的根本原因是___________ 。
(4)装置B中所得KI溶液经分离提纯后得到KI粗产品,为测定KI的纯度,称取1.0g样品溶于水,然后用0.0500mol·L-1酸性KMnO4标准溶液滴定( ),杂质不与酸性KMnO4溶液反应。平行滴定三次,滴定到终点平均消耗酸性KMnO4标准溶液20.00mL,则样品的纯度为
),杂质不与酸性KMnO4溶液反应。平行滴定三次,滴定到终点平均消耗酸性KMnO4标准溶液20.00mL,则样品的纯度为___________ (保留两位有效数字)。
(二)实验探究:FeCl3与KI的反应
(5)证明实验I中有I2生成,加入的试剂为(有机溶剂除外)___________ 。
(6)已知在酸性较强的条件下,I-可被空气氧化为I2,为探究实验I中20min后棕黄色变深的原因,甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验I中溶液棕黄色变深。甲同学设计的实验为:___________ ,若20min后溶液不变蓝,证明该假设不成立。(可选试剂:0.1mol·L-1KI溶液、0.1mol·L-1FeCl3溶液、淀粉溶液、稀硫酸)
(7)乙同学查阅资料可知:① ;②FeCl3与KI反应的平衡体系中还存在反应
;②FeCl3与KI反应的平衡体系中还存在反应 ,
, 呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20min后溶液红色变浅的原因:
呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20min后溶液红色变浅的原因:___________ 。
(一)制备KI
某实验小组设计制备一定量KI的实验(加热及夹持装置已省略)如下:
反应I:
反应Ⅱ:

(1)实验开始前,先进行装置气密性检查:将C中导管下端管口浸入液面以下,塞紧瓶塞,微热A装置,若
(2)在装置B中先滴入KOH溶液,待观察到三颈烧瓶中溶液颜色由
(3)实验中不能用稀硝酸代替稀硫酸的根本原因是
(4)装置B中所得KI溶液经分离提纯后得到KI粗产品,为测定KI的纯度,称取1.0g样品溶于水,然后用0.0500mol·L-1酸性KMnO4标准溶液滴定(
(二)实验探究:FeCl3与KI的反应
| 序号 | 操作 | 现象 |
| 实验I | 取5mL0.1mol·L-1KI溶液,滴加0.1mol·L-1 FeCl3溶液5~6滴(混合溶液的pH=5) | 溶液变为棕黄色,20min后棕黄色变深 |
| 实验Ⅱ | 取少量实验I中棕黄色溶液于试管中,滴加2滴KSCN溶液 | 溶液变红,20min后红色变浅 |
(5)证明实验I中有I2生成,加入的试剂为(有机溶剂除外)
(6)已知在酸性较强的条件下,I-可被空气氧化为I2,为探究实验I中20min后棕黄色变深的原因,甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验I中溶液棕黄色变深。甲同学设计的实验为:
(7)乙同学查阅资料可知:①
1811年,法国化学家库尔图瓦将浓硫酸和海草灰(富含KI)混合后发现有紫色蒸气生成,该蒸气冷凝后变为紫黑色晶体。1813年经盖-吕萨克鉴定后正式将该物质命名为Iodine(碘)。
(1)将浓H2SO4滴入盛有KI固体的锥形瓶中,产生的气体能使湿润的醋酸铅试纸变黑(已知黑色物质为PbS),则该反应除生成I2以外,还会生成气体_______ (填化学式)。
(2)常温时HI为无色气体,易溶于水。其制备原理为3KI+H3PO4(浓) K3PO4+3HI↑。如图所示,制备并收集干燥的HI气体所需装置的接口顺序为(装置可重复使用,夹持和加热装置省略):a→e,f→
K3PO4+3HI↑。如图所示,制备并收集干燥的HI气体所需装置的接口顺序为(装置可重复使用,夹持和加热装置省略):a→e,f→_______ (已知浓H3PO4不易挥发和分解)。其中仪器Q的名称为_______ 。
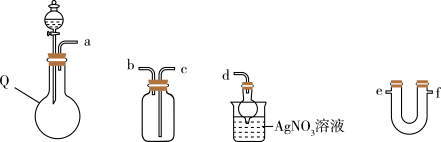
U形干燥管中的试剂为_______ 。若观察到_______ ,说明HI气体己收集满。
(3)久置KI溶液易被氧化导致变质,某实验小组取久置KI溶液进行实验,如图所示。
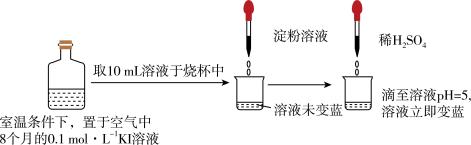
关于溶液立即变蓝的原因,该实验小组进行了如下探究。
①提出猜想
猜想Ⅰ:酸性条件下,空气中的O2将I-迅速氧化成I2;
猜想Ⅱ:KI溶液久置过程中产生了IO ,IO
,IO 在酸性条件下与I-反应生成I2。
在酸性条件下与I-反应生成I2。
②实验与结论。
③分析:久置KI溶液中IO 的产生可认为经历了两个过程
的产生可认为经历了两个过程_______ (写离子方程式);3I2+6OH-=5I-+IO +3H2O。
+3H2O。
(1)将浓H2SO4滴入盛有KI固体的锥形瓶中,产生的气体能使湿润的醋酸铅试纸变黑(已知黑色物质为PbS),则该反应除生成I2以外,还会生成气体
(2)常温时HI为无色气体,易溶于水。其制备原理为3KI+H3PO4(浓)

U形干燥管中的试剂为
(3)久置KI溶液易被氧化导致变质,某实验小组取久置KI溶液进行实验,如图所示。

关于溶液立即变蓝的原因,该实验小组进行了如下探究。
①提出猜想
猜想Ⅰ:酸性条件下,空气中的O2将I-迅速氧化成I2;
猜想Ⅱ:KI溶液久置过程中产生了IO
②实验与结论。
| 实验编号 | 实验方案 | 实验现象 | 结论与解释 |
| i | 往试管中加入10mL0.1mol•L-1新制KI溶液并加入几滴淀粉溶液, | 50min后溶液变蓝 | 猜想Ⅰ不成立。判断的依据是 |
| ii | 取少量KIO3溶液与少量KI溶液混合,加入淀粉溶液,再滴加稀H2SO4。 | 溶液立即 变蓝 | 猜想Ⅱ成立。写出相关反应离子方程式: |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


