解答题-原理综合题 适中0.65 引用2 组卷314
甲醇既是重要的化工原料,又是一种清洁燃料。利用CO,加氢合成甲醇的主要反应如下:
Ⅰ.CO2(g) + 3H2 (g) CH3OH(g) + H2O(g) ΔH1
CH3OH(g) + H2O(g) ΔH1
Ⅱ.CO2(g) + H2(g) CO(g)+H2O(g) ΔH2>0
CO(g)+H2O(g) ΔH2>0
回答下列问题:
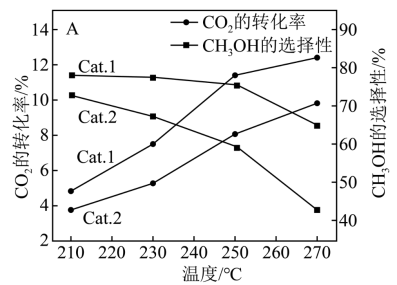
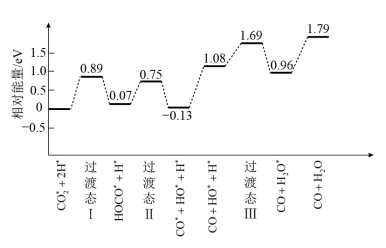
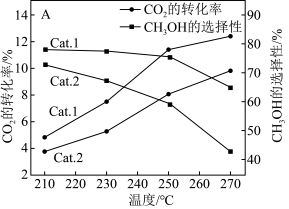
(1)我国学者结合实验与计算机模拟结果,研究了光催化CO2加氢合成甲醇的反应历程,如下图所示,其中吸附在催化剂表面的物种用*表示。
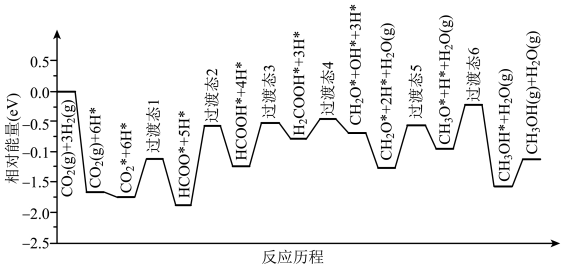
①ΔH1___________ 0(填“>”或“<”)。
②图示历程包含___________ 个基元反应,其中最大能垒(活化能)步骤的化学方程式为___________ 。
(2)向刚性容器中充入一定量CO2和H2,在相同压强和不同温度下,反应相同时间,CO2的转化率和甲醇选择性[已知甲醇的选择性= ]随温度的变化如下图所示:
]随温度的变化如下图所示:
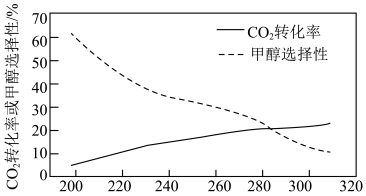
在200~300℃间,CH3OH的选择性随温度的升高而下降,写出一条可能原因___________ 。
(3)一定条件下,向刚性容器中充入物质的量之比为1:3的CO2和H2,发生上述反应Ⅰ和Ⅱ。
①有利于提高甲醇平衡产率的条件是___________ (填标号)。
A.高温高压 B.低温高压 C.高温低压 D.低温低压
②达到平衡时CO2的转化率为20%,CH3OH的选择性为75%,则a(H2)=___________ (计算结果保留3位有效数字);反应Ⅱ的Kp=___________ 。
Ⅰ.CO2(g) + 3H2 (g)
Ⅱ.CO2(g) + H2(g)
回答下列问题:
(1)我国学者结合实验与计算机模拟结果,研究了光催化CO2加氢合成甲醇的反应历程,如下图所示,其中吸附在催化剂表面的物种用*表示。

①ΔH1
②图示历程包含
(2)向刚性容器中充入一定量CO2和H2,在相同压强和不同温度下,反应相同时间,CO2的转化率和甲醇选择性[已知甲醇的选择性=

在200~300℃间,CH3OH的选择性随温度的升高而下降,写出一条可能原因
(3)一定条件下,向刚性容器中充入物质的量之比为1:3的CO2和H2,发生上述反应Ⅰ和Ⅱ。
①有利于提高甲醇平衡产率的条件是
A.高温高压 B.低温高压 C.高温低压 D.低温低压
②达到平衡时CO2的转化率为20%,CH3OH的选择性为75%,则a(H2)=
23-24高三上·湖北武汉·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网