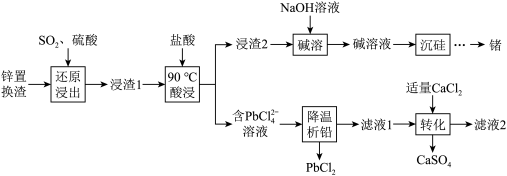
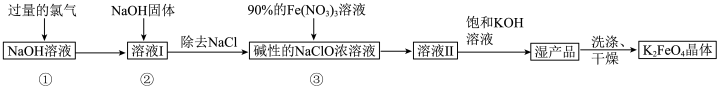
解答题-工业流程题 适中0.65 引用2 组卷283
高铁酸钾 是新型多功能水处理剂,其生产工艺如图所示:
是新型多功能水处理剂,其生产工艺如图所示:
已知:① 与
与 溶液反应的产物与反应温度有关,温度较低时产物为
溶液反应的产物与反应温度有关,温度较低时产物为 和
和 ;温度较高时产物为
;温度较高时产物为 和
和 。
。
②同一条件下,溶液的碱性越强,高铁酸盐的稳定性越高。
回答下列问题:
(1)写出 与
与 溶液在较高温度下反应的离子方程式:
溶液在较高温度下反应的离子方程式:___________ 。
(2)向“溶液Ⅰ”中加入 固体起到的作用有降低
固体起到的作用有降低 的溶解度、
的溶解度、___________ 、___________ ;
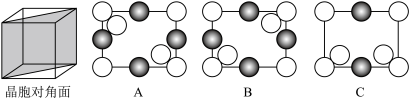
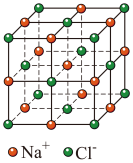
(3) 晶胞结构如图,设晶胞边长为apm,NA为阿伏加德罗常数的值,则距离最近的
晶胞结构如图,设晶胞边长为apm,NA为阿伏加德罗常数的值,则距离最近的 间的距离为
间的距离为___________  ,该晶体的密度为
,该晶体的密度为___________  。(列出计算式)
。(列出计算式)
(4)配制 溶液时,将
溶液时,将 固体溶解在
固体溶解在 水中(水的密度近似为
水中(水的密度近似为 ),所得溶液的密度为
),所得溶液的密度为 ,则该溶液的物质的量浓度为
,则该溶液的物质的量浓度为___________  。(保留3位有效数字)
。(保留3位有效数字)
(5)步骤③发生的反应中氧化剂与还原剂的物质的量之比n(氧化剂)∶n(还原剂)
___________ 。对“湿产品”进行“洗涤、干燥”时,洗涤剂最好选用___________ (填标号)溶液和异丙醇。
A. B.
B. C.
C.

已知:①
②同一条件下,溶液的碱性越强,高铁酸盐的稳定性越高。
回答下列问题:
(1)写出
(2)向“溶液Ⅰ”中加入
(3)

(4)配制
(5)步骤③发生的反应中氧化剂与还原剂的物质的量之比n(氧化剂)∶n(还原剂)
A.
2023·黑龙江大庆·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网