解答题-原理综合题 适中0.65 引用2 组卷255
用 制备
制备 ,既可减少碳排放,又可获得实用的含碳物质,有利于实现“双碳”目标。主要反应为:
,既可减少碳排放,又可获得实用的含碳物质,有利于实现“双碳”目标。主要反应为:
I.

II.
 。
。
回答下列问题:
(1)①25℃,101kPa时,CO的燃烧热为283 ,
, 的燃烧热为286
的燃烧热为286 ;
;
②
 。
。
则
_________  。反应I能自发进行的条件是
。反应I能自发进行的条件是________ (填“高温”或“低温”)。
(2)向某刚性容器中,按投料比 充入
充入 和
和 在不同催化剂(M、N)下发生上述反应。一段时间后,测得
在不同催化剂(M、N)下发生上述反应。一段时间后,测得 的转化率、
的转化率、 的选择性(含碳生成物中
的选择性(含碳生成物中 的百分含量)随温度的变化如图所示。
的百分含量)随温度的变化如图所示。
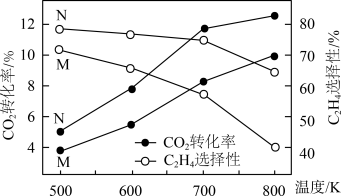
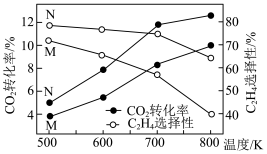
①由图可知,催化效果M___________ N(填“优于”或“劣于”)。
②已知活化能 (看作不受温度影响),反应温度T和速率常数k之间符合公式:
(看作不受温度影响),反应温度T和速率常数k之间符合公式: (R和C为常数),下列关于反应Ⅰ在题设条件下的
(R和C为常数),下列关于反应Ⅰ在题设条件下的 图像与上述两种催化剂关系对应正确的是
图像与上述两种催化剂关系对应正确的是___________ (填标号)。
a.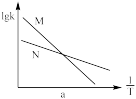 b.
b.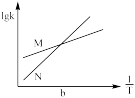 c.
c.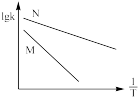 d.
d.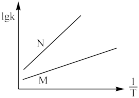
③500~800K之间,乙烯的选择性随温度变化的原因是___________ 。
④能加快制备 的速率且提高
的速率且提高 选择性的措施有
选择性的措施有___________ (填标号)。
A.降低温度 B.增大压强 C.移走 (g) D.更换适宜的催化剂
(g) D.更换适宜的催化剂
(3)T℃时,在恒容容器中加入1molCO(g)、1mol (g)以及催化剂,仅发生反应II。反应后测得各组分的平衡分压:
(g)以及催化剂,仅发生反应II。反应后测得各组分的平衡分压: 和
和 ,则反应的平衡常数
,则反应的平衡常数
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
I.
II.
回答下列问题:
(1)①25℃,101kPa时,CO的燃烧热为283
②
则
(2)向某刚性容器中,按投料比

①由图可知,催化效果M
②已知活化能
a.
 b.
b. c.
c. d.
d.
③500~800K之间,乙烯的选择性随温度变化的原因是
④能加快制备
A.降低温度 B.增大压强 C.移走
(3)T℃时,在恒容容器中加入1molCO(g)、1mol
23-24高三上·湖北孝感·开学考试
类题推荐
用 制备
制备 有利于实现“双碳”目标。涉及的主要反应为:
有利于实现“双碳”目标。涉及的主要反应为:
Ⅰ.

Ⅱ.

(1)已知 时,部分物质的相对能量如下表所示(忽略
时,部分物质的相对能量如下表所示(忽略 随温度的变化):
随温度的变化):
则
___________  。
。
(2)在一定条件下的密闭容器中发生上述反应,若要提高反应Ⅰ中 的平衡转化率并加快反应速率,可以采取的措施有___________(填标号)。
的平衡转化率并加快反应速率,可以采取的措施有___________(填标号)。
(3)向某刚性容器中按投料比 充入
充入 和
和 ,在不同催化剂(M、N)下发生上述反应。一段时间后,测得
,在不同催化剂(M、N)下发生上述反应。一段时间后,测得 的转化率、
的转化率、 的选择性(含碳生成物中
的选择性(含碳生成物中 的百分含量)随温度的变化如图所示。
的百分含量)随温度的变化如图所示。
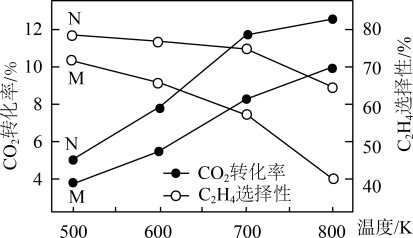
①由图可知,___________ 的催化效果好(填“M”或“N”)。
②500~800K之间,乙烯的选择性随温度变化的原因是___________ 。
(4)在一定条件下,向密闭容器中充入 和
和 ,发生反应
,发生反应 。测得相同时间内,
。测得相同时间内, 的转化率随温度的变化如图所示(虚线表示
的转化率随温度的变化如图所示(虚线表示 的平衡转化率随温度的变化)。
的平衡转化率随温度的变化)。
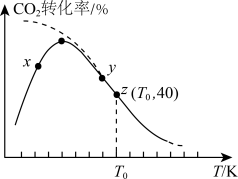
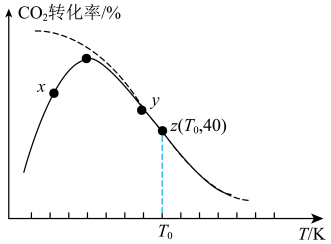
①由图分析,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②已知z点体系的压强为 ,则
,则 时,该反应的标准平衡常数
时,该反应的标准平衡常数
___________ (保留2位小数,已知:分压=总压×该组分物质的量分数,对于反应 ,
, ,其中
,其中 ,
, 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。
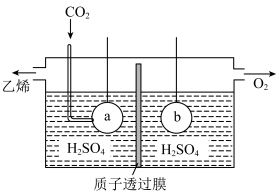
(5)利用电解法制取乙烯的装置如下图所示,则电极a的反应式为___________ 。
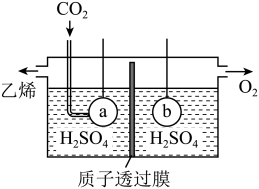
Ⅰ.
Ⅱ.
(1)已知
| 物质 | ||||||
| 相对能量(kJ/mol) | -393 | -286 | -242 | -110 | 0 | 52 |
(2)在一定条件下的密闭容器中发生上述反应,若要提高反应Ⅰ中
| A.增大压强 | B.增大 |
| C.降低温度 | D.液化分离出水蒸气 |

①由图可知,
②500~800K之间,乙烯的选择性随温度变化的原因是
(4)在一定条件下,向密闭容器中充入

①由图分析,
②已知z点体系的压强为
(5)利用电解法制取乙烯的装置如下图所示,则电极a的反应式为

用 制备
制备 有利于实现“双碳”目标。涉及的主要反应为:
有利于实现“双碳”目标。涉及的主要反应为:
Ⅰ.2CO2(g)+6H2(g) C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g) 
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g) 
(1)已知 时,部分物质的相对能量如下表所示(忽略
时,部分物质的相对能量如下表所示(忽略 随温度的变化):则
随温度的变化):则
___________  。
。
(2)在一定条件下的密闭容器中发生上述反应,若要提高反应Ⅰ中 的平衡转化率并加快反应速率,可以采取的措施有___________(填标号)。
的平衡转化率并加快反应速率,可以采取的措施有___________(填标号)。
(3)向某刚性容器中按投料比 充入
充入 和
和 ,在不同催化剂(M、N)下发生上述反应。一段时间后,测得
,在不同催化剂(M、N)下发生上述反应。一段时间后,测得 的转化率、
的转化率、 的选择性(含碳生成物中
的选择性(含碳生成物中 的百分含量)随温度的变化如图所示。
的百分含量)随温度的变化如图所示。___________ 的催化效果好(填“M”或“N”)。
②500~800K之间,乙烯的选择性随温度变化的原因是___________ 。
(4)在一定条件下,向密闭容器中充入 和
和 ,发生反应2CO2(g)+6H2(g)
,发生反应2CO2(g)+6H2(g) C2H4(g)+4H2O(g) 。测得相同时间内,
C2H4(g)+4H2O(g) 。测得相同时间内, 的转化率随温度的变化如图所示(虚线表示
的转化率随温度的变化如图所示(虚线表示 的平衡转化率随温度的变化)。
的平衡转化率随温度的变化)。
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②已知z点体系的压强为 ,则
,则 时,该反应的标准平衡常数
时,该反应的标准平衡常数
___________ (保留2位小数,已知:分压=总压×该组分物质的量分数,对于反应的dD(g)+eE(g) gG(g)+ hH (g),
gG(g)+ hH (g), ,其中
,其中 ,
, 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。
(5)利用电解法制取乙烯的装置如图所示,则电极a为电解池的___________ 极,a极反应式为___________ 。
Ⅰ.2CO2(g)+6H2(g)
Ⅱ.CO2(g)+H2(g)
(1)已知
| 物质 | ||||||
| 相对能量(kJ/mol) | -393 | -286 | -242 | -110 | 0 | 52 |
(2)在一定条件下的密闭容器中发生上述反应,若要提高反应Ⅰ中
| A.增大压强 | B.增大 |
| C.降低温度 | D.液化分离出水蒸气 |
(3)向某刚性容器中按投料比
②500~800K之间,乙烯的选择性随温度变化的原因是
(4)在一定条件下,向密闭容器中充入
②已知z点体系的压强为
(5)利用电解法制取乙烯的装置如图所示,则电极a为电解池的
用 制备
制备 ,有利于实现“双碳”目标。主要反应为:
,有利于实现“双碳”目标。主要反应为:
I.

II.

(1)已知298K时,部分物质的相对能量如下表所示(忽略 随温度的变化)。
随温度的变化)。
则
___________  。
。
(2)向某刚性容器中,按投料比 充入
充入 和
和 ,在不同催化剂(M、N)下发生上述反应。一段时间后,测得
,在不同催化剂(M、N)下发生上述反应。一段时间后,测得 的转化率
的转化率 的选择性(含碳生成物中
的选择性(含碳生成物中 的百分含量)随温度的变化如图1所示。
的百分含量)随温度的变化如图1所示。
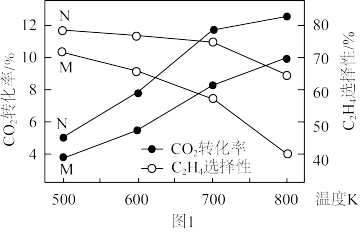
①由图可知,___________ 的催化效果好(填“M”或“N”)。
②500~800K之间,乙烯的选择性随温度变化的原因是___________ 。
(3)在一定条件下,向密闭容器中充入5.0mol 和8.0mol
和8.0mol ,发生反应
,发生反应 。测得相同时间内,
。测得相同时间内, 的转化率随温度的变化如图2所示(虚线表示
的转化率随温度的变化如图2所示(虚线表示 的平衡转化率随温度的变化);速率常数的对数
的平衡转化率随温度的变化);速率常数的对数 与温度的倒数
与温度的倒数 之间的关系如图3所示。
之间的关系如图3所示。
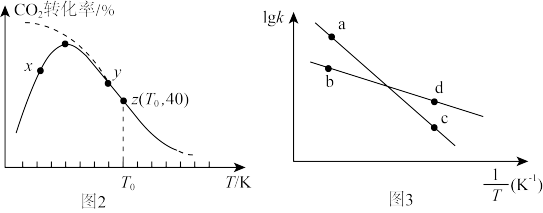
①由图可知,
___________  (填“>”、“<”或“=”);已知z点体系的压强为200kPa,则
(填“>”、“<”或“=”);已知z点体系的压强为200kPa,则 时,该反应的标准平衡常数
时,该反应的标准平衡常数
___________ (保留2位小数,已知:分压=总压×该组分物质的量分数,对于反应 ,
, ,其中
,其中 ,
, 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。
②已知速率方程 ,
, ,
, 、
、 是速率常数。图中a、b、c、d分别代表x点、z点的速率常数,其中
是速率常数。图中a、b、c、d分别代表x点、z点的速率常数,其中___________ 点表示x点的 ;升高温度时,
;升高温度时,
___________ (填“增大”、“减小”或“不变”)。
I.
II.
(1)已知298K时,部分物质的相对能量如下表所示(忽略
| 物质 | ||||||
| 相对能量(kJ·mol) | -393 | -286 | -242 | -110 | 0 | 52 |
(2)向某刚性容器中,按投料比

①由图可知,
②500~800K之间,乙烯的选择性随温度变化的原因是
(3)在一定条件下,向密闭容器中充入5.0mol

①由图可知,
②已知速率方程
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


