解答题-原理综合题 适中0.65 引用2 组卷174
Deacon直接氧化法可将HC1转化为Cl2,提高效益,减少污染,反应原理为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。
(1)Deacon直接氧化法可按下列催化过程进行:
2CuCl2(s)=2CuCl(s)+Cl2(g) △H1=+166 kJ·mol-1
2CuCl(s)+O2(g)=2CuO(s)+Cl2(g) △H2=-40kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) △H3=-121 kJ·mol-1
则上述总反应的热化学方程式为___________ 。
(2)在一刚性容器中,当进料浓度比c(HCl):c(O2)=5:1时,实验测得HCl平衡转化率随温度变化的a(HCl)—T曲线如图所示:
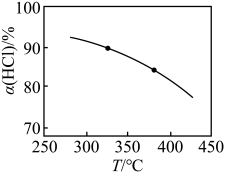
①一定温度下,下列选项表明该反应一定达到平衡状态的是 ___________ (填标号)。
A.HCl与O2的物质的量之比不改变
B.HCl与Cl2的物质的量之比等于2:1
C.容器内的压强不再改变
D.断裂n mol H-Cl键的同时形成 n mol H-O键
②250℃、400℃两点的平衡常数K250℃___________ K400℃(填“>”“<”或“=”)。在相同容器中若进料浓度比c(HCl):c(O2)=1:1时,所得转化率a(HCl)比之前___________ (填“大”、“小”或“等于”)。
③温度不变时,进一步提高HCl的转化率的方法是___________ (任写一种)。
(3)若在绝热的刚性容器中投入原料比为n(HCl):n(O2)=1:1的反应混合物,起始时总物质的量为8mol,测得反应过程中c(Cl2)的数据如下:
①2.0~6.0 min内以O2表示的反应速率为___________ 。
②实验发现产生Cl2的速率先增大后减小,分析其原因:___________ 。
③若在恒温的刚性容器中完成这个反应,15min时候测得Cl2产率为50%,问反应前后的压强之比:___________ 。
(1)Deacon直接氧化法可按下列催化过程进行:
2CuCl2(s)=2CuCl(s)+Cl2(g) △H1=+166 kJ·mol-1
2CuCl(s)+O2(g)=2CuO(s)+Cl2(g) △H2=-40kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) △H3=-121 kJ·mol-1
则上述总反应的热化学方程式为
(2)在一刚性容器中,当进料浓度比c(HCl):c(O2)=5:1时,实验测得HCl平衡转化率随温度变化的a(HCl)—T曲线如图所示:

| 平衡时HCl转化率a | 93% | 90% | 87% | 85% | 82% |
| T ℃ | 250 | 300 | 350 | 400 | 450 |
A.HCl与O2的物质的量之比不改变
B.HCl与Cl2的物质的量之比等于2:1
C.容器内的压强不再改变
D.断裂n mol H-Cl键的同时形成 n mol H-O键
②250℃、400℃两点的平衡常数K250℃
③温度不变时,进一步提高HCl的转化率的方法是
(3)若在绝热的刚性容器中投入原料比为n(HCl):n(O2)=1:1的反应混合物,起始时总物质的量为8mol,测得反应过程中c(Cl2)的数据如下:
| t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| c(Cl2)/10-1mol·L-1 | 0 | 1.5 | 5.4 | 6.5 | 7.4 | 8.0 |
②实验发现产生Cl2的速率先增大后减小,分析其原因:
③若在恒温的刚性容器中完成这个反应,15min时候测得Cl2产率为50%,问反应前后的压强之比:
23-24高三上·四川绵阳·阶段练习
类题推荐
Deacon直接氧化法可将HCl转化为Cl2,提高效益,减少污染,反应原理为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。
(1)在一刚性容器中,当进料浓度比c(HCl):c(O2)=4:1时,实验测得HCl平衡转化率随温度变化的α(HCl)—T曲线如图:

①一定温度下,下列选项表明该反应一定达到平衡状态的是_______ (填标号)。
A.HCl与O2的物质的量之比不改变
B.HCl与Cl2的物质的量之比不改变
C. 容器内的压强不再改变
D. 断裂n mol H-Cl键的同时形成n mol H-O键
E. 混合气体的平均相对分子质量不变
②在相同容器中若进料浓度比c(HCl):c(O2)=1:1时,所得α(HCl)—T曲线在曲线AB的_______ 方(填“上”或“下”)。
③温度不变时,进一步提高HCl的转化率的方法是_______ 、_______ (写出2种)。
(2)若在一定温度的刚性容器中投入原料HCl和O2的混合物发生反应,测得反应过程中c(Cl2)的数据如下:
2.0~6.0 min内以HCl表示的反应速率为_______ 。
(3)利用Au/Ag3PO4光催化去除氮氧化物(O2将氮氧化物氧化为NO ),研究表明,不同Au的负载量与氮氧化物的去除效果、催化去除速率常数(用k表示,其他条件不变时,速率常数越大,速率越大)大小的关系分别如图1、图2表示。已知:催化剂的活性与其表面的单位面积活性位点数有关。
),研究表明,不同Au的负载量与氮氧化物的去除效果、催化去除速率常数(用k表示,其他条件不变时,速率常数越大,速率越大)大小的关系分别如图1、图2表示。已知:催化剂的活性与其表面的单位面积活性位点数有关。
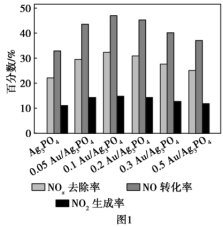
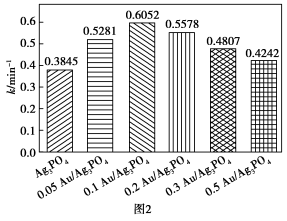
①综合图1、图2可知催化效果最佳的是_______ (填催化剂)。
②图2中表面随着Au的负载量不断增加,反应速率常数先增大后减小,试分析反应速率常数减小的原因是_______
(1)在一刚性容器中,当进料浓度比c(HCl):c(O2)=4:1时,实验测得HCl平衡转化率随温度变化的α(HCl)—T曲线如图:

①一定温度下,下列选项表明该反应一定达到平衡状态的是
A.HCl与O2的物质的量之比不改变
B.HCl与Cl2的物质的量之比不改变
C. 容器内的压强不再改变
D. 断裂n mol H-Cl键的同时形成n mol H-O键
E. 混合气体的平均相对分子质量不变
②在相同容器中若进料浓度比c(HCl):c(O2)=1:1时,所得α(HCl)—T曲线在曲线AB的
③温度不变时,进一步提高HCl的转化率的方法是
(2)若在一定温度的刚性容器中投入原料HCl和O2的混合物发生反应,测得反应过程中c(Cl2)的数据如下:
| t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| c(Cl2)/10-3 mol·L-1 | 0 | 1.8 | 3.7 | 5.4 | 7.2 | 8.3 |
2.0~6.0 min内以HCl表示的反应速率为
(3)利用Au/Ag3PO4光催化去除氮氧化物(O2将氮氧化物氧化为NO


①综合图1、图2可知催化效果最佳的是
②图2中表面随着Au的负载量不断增加,反应速率常数先增大后减小,试分析反应速率常数减小的原因是
近年来,随着聚酯工业的快速发展,Cl2的需求量和HCl的产出量也随之迅速增长。Deacon发明了直接氧化法(称作Deacon反应): 。
。
用O2将HCl转化为Cl2,可提高效益,减少污染。
回答下列问题:
(1)传统上Deacon反应可通过如图所示的催化剂循环实现。

Deacon反应的△H=_______ (用△H1和△H2表示)
(2)在恒温、体积为1L的刚性密闭容器中发生Deacon反应,HCl、O2初始投料分别为4mol、1mol。实验测得HCl平衡转化率(α(HCl))随温度变化的曲线如图。
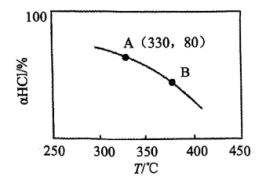
①下列说法能说明Deacon反应在此条件下到达平衡状态的有________ 。
A. B.H2O的质量分数不变
B.H2O的质量分数不变
C. 不变 D.
不变 D. 不变
不变
②Deacon反应的△H________ 0(填“>”、“=”或“<”,下同),A、B两点的平衡常数K(A)与K(B)的大小关系是K(A)________ K(B)。
③Deacon反应在A点的平衡常数K=________ 。
④保持温度及投料比不变,提高HCl的平衡转化率的方法有________ 。(写出2种)
⑤若HCl、O2初始投料分别为5mol、1mol,画出相应α(HCl)-T曲线的示意图__________ 。
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
2.0~6.0min内以HCl的物质的量变化表示的反应速率为_______ mol·min-1。
用O2将HCl转化为Cl2,可提高效益,减少污染。
回答下列问题:
(1)传统上Deacon反应可通过如图所示的催化剂循环实现。

Deacon反应的△H=
(2)在恒温、体积为1L的刚性密闭容器中发生Deacon反应,HCl、O2初始投料分别为4mol、1mol。实验测得HCl平衡转化率(α(HCl))随温度变化的曲线如图。

①下列说法能说明Deacon反应在此条件下到达平衡状态的有
A.
C.
②Deacon反应的△H
③Deacon反应在A点的平衡常数K=
④保持温度及投料比不变,提高HCl的平衡转化率的方法有
⑤若HCl、O2初始投料分别为5mol、1mol,画出相应α(HCl)-T曲线的示意图
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
0 | 2.0 | 4.0 | 6.0 | 8.0 | |
0 | 1.8 | 3.7 | 5.4 | 7.2 |
许多有氯气参与的工业生产中,消耗氯气的同时,通常会产生大量的副产物氯化氢。工业上可采用氯化氢催化氧化法制取氯气,实现氯资源循环利用,既可提高经济效益,又能减少HCl污染问题。有关反应原理为4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) △H=-116kJ·mol-1,该过程具有能耗低、操作简单等优点,目前是最容易实现工业化的方法。回答下列问题:
2Cl2(g)+2H2O(g) △H=-116kJ·mol-1,该过程具有能耗低、操作简单等优点,目前是最容易实现工业化的方法。回答下列问题:
(1)Deacon过程是最早也是最具有代表性的催化氧化法,由Deacon在1875年首先提出。Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+ Cl2(g) △H1=+83kJ·mol-1
Cl2(g) △H1=+83kJ·mol-1
CuCl(s)+ O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) △H2=-20kJ·mol-1
Cl2(g) △H2=-20kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) △H3
其中,△H3=____ kJ·mol-1。
(2)关于氯化氢催化氧化法制氯气的反应,下列说法正确的是____ (填字母)。
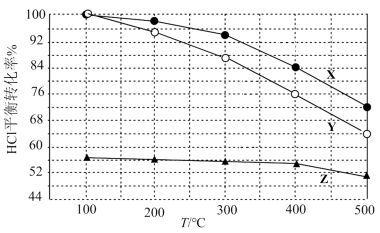
(3)如图为容积一定的容器中,不同进料浓度比( )时HCl平衡转化率随温度变化的关系,其中进料浓度比最大的是
)时HCl平衡转化率随温度变化的关系,其中进料浓度比最大的是____ 曲线(用“X、Y或Z”表示)。在温度一定、进料浓度比一定的条件下,能进一步提高HCl转化率的方法是:____ (写出2种方法)。
(4)一定温度下,当进料比n(HCl):n(O2)=8:3时,若平衡时HCl的转化率为50%,体系的总压为PkPa。计算该温度下反应:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)的压强平衡常数Kp=
2Cl2(g)+2H2O(g)的压强平衡常数Kp=___ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)350℃时,若某密闭容器中氯化氢催化氧化制氯气的反应的平衡常数K=25.0(mol·L-1)-1(以平衡浓度表示的平衡常数),正反应速率v正=k正c4(HCl)•c(O2),逆反应速率v逆=k逆c2(Cl2)•c2(H2O),其中k正、k逆为速率常数,则k逆=____ (用含K和k正的式子表示);若k正=0.45(mol·L-1)-4·min-1,40min时反应达到平衡状态,c(Cl2)=c(H2O)=0.5mol·L-1,v逆=___ mol·L-1·min-1。
(1)Deacon过程是最早也是最具有代表性的催化氧化法,由Deacon在1875年首先提出。Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+
CuCl(s)+
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) △H3
其中,△H3=
(2)关于氯化氢催化氧化法制氯气的反应,下列说法正确的是
| A.催化氧化反应(Deacon制氯法)中,所使用的催化剂是CuCl |
| B.容器内气体的颜色不再变化时,说明该反应达到平衡状态 |
| C.反应达到平衡后,降低温度,能加快正反应速率,减小逆反应速率,使平衡正向移动 |
| D.其他条件一定时,氧气的投料越多,平衡时Cl2的体积分数越大 |

(4)一定温度下,当进料比n(HCl):n(O2)=8:3时,若平衡时HCl的转化率为50%,体系的总压为PkPa。计算该温度下反应:4HCl(g)+O2(g)
(5)350℃时,若某密闭容器中氯化氢催化氧化制氯气的反应的平衡常数K=25.0(mol·L-1)-1(以平衡浓度表示的平衡常数),正反应速率v正=k正c4(HCl)•c(O2),逆反应速率v逆=k逆c2(Cl2)•c2(H2O),其中k正、k逆为速率常数,则k逆=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


