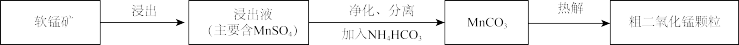解答题-工业流程题 较难0.4 引用2 组卷318
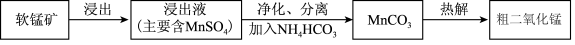
(1)浸出。用
(2)净化、分离。
①浸出液中的
②为减少碱用量,可以通过稀释浸出液除去
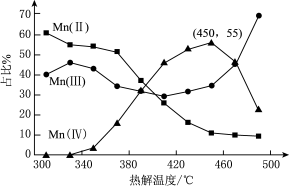
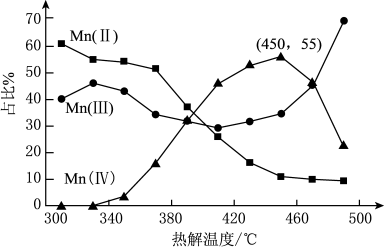
(3)热解。在一定空气流速下,相同时间内
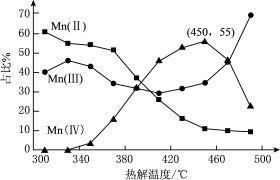
注:图中
ⅰ.
ⅱ.
ⅲ.
①为了增大产物中
②温度升高,产物中
(4)测定
(5)分析
23-24高三上·江苏镇江·开学考试
类题推荐  是一种两性氧化物,用软锰矿(主要成分为
是一种两性氧化物,用软锰矿(主要成分为 ,含少量铁的氧化物)和BaS可制备高纯
,含少量铁的氧化物)和BaS可制备高纯 、
、 。
。
(1)酸性条件下,双氧水能促进软锰矿溶浸生成 ,其反应的离子方程式
,其反应的离子方程式___________ 。
(2)由 溶液制备
溶液制备 :在30℃~35℃下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到
:在30℃~35℃下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到 沉淀。该反应的化学方程式为
沉淀。该反应的化学方程式为___________ 。
(3)利用 与BaS溶液反应制
与BaS溶液反应制 。
。
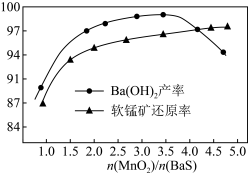
①保持BaS投料量不变,随 与BaS投料比增大,软锰矿还原率和氢氧化钡的产率的变化如图所示。
与BaS投料比增大,软锰矿还原率和氢氧化钡的产率的变化如图所示。 时,
时, 产率减小的原因是
产率减小的原因是___________ 。
②充分反应后过滤,滤液经过___________ 。可获得 晶体。
晶体。
(4)利用(3)反应后的滤渣中还含有铁的氧化物和未反应的 制备高纯度
制备高纯度 溶液。已知:常温下溶液中金属离子开始沉淀和完全沉淀的pH如表所示。
溶液。已知:常温下溶液中金属离子开始沉淀和完全沉淀的pH如表所示。
设计制备高纯度 溶液的实验方案:向滤渣中加入一定体积的稀硫酸和稍过量的
溶液的实验方案:向滤渣中加入一定体积的稀硫酸和稍过量的 溶液,充分还原后的混和溶液过滤,向滤液中
溶液,充分还原后的混和溶液过滤,向滤液中___________ ,过滤,得到高纯度 溶液。实验中须使用的试剂:5%
溶液。实验中须使用的试剂:5% 溶液、
溶液、 。
。
(5)测定 粗品的纯度。称取0.1450 g
粗品的纯度。称取0.1450 g 粗品置于具塞锥形瓶中,加水润湿后,依次加入足量稀硫酸和过量KI溶液。盖上玻璃塞,充分摇匀后静置30 min。用0.1500 mol/L
粗品置于具塞锥形瓶中,加水润湿后,依次加入足量稀硫酸和过量KI溶液。盖上玻璃塞,充分摇匀后静置30 min。用0.1500 mol/L 标准溶液滴定生成的
标准溶液滴定生成的 ,消耗
,消耗 标准溶液20.00 mL。滴定反应为
标准溶液20.00 mL。滴定反应为 ,计算粗品中
,计算粗品中 的质量分数
的质量分数___________ (写出计算过程)。
(1)酸性条件下,双氧水能促进软锰矿溶浸生成
(2)由
(3)利用
①保持BaS投料量不变,随
②充分反应后过滤,滤液经过
(4)利用(3)反应后的滤渣中还含有铁的氧化物和未反应的
| 物质 | |||
| 开始沉淀时的pH | 6.5 | 1.5 | 7.7 |
| 完全沉淀时( | 9.7 | 3.7 | 9.8 |
(5)测定
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网