解答题-原理综合题 适中0.65 引用5 组卷139
氮氧化物对环境有着巨大的危害,一种利用尿素[CO(NH2)2]脱硝的反应原理为 △H<0,回答下列问题:
△H<0,回答下列问题:
(1)T℃时,往2L的恒容密闭容器中加入5molCO(NH2)2(s)和3 mol NO(g),容器内混合气体总物质的量随时间的变化如图所示。
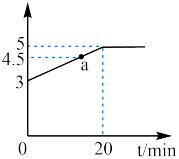
①20min末,容器内N2的物质的量为_______ mol;0~20min内,NO的平均反应速率为_______ mol·L-l·min-l。
②a点时v正_______ (填“>”、“<”或“=”)v逆,此时NO的转化率为_______ %;平衡时与初始时容器内的压强比为_______ 。
(2)向恒温恒容的密闭容器中,加入一定量的CO(NH2)2(s)和NO(g),能够说明该反应达到平衡的是_______(填标号)。
(3)汽车尾气中含有CO和NO等有害气体,三元催化转化器可将汽车尾气中的CO和NO转化为CO2和N2,每生成14gN2,反应放出373kJ热量,该反应的热化学方程式为_______ 。
(1)T℃时,往2L的恒容密闭容器中加入5molCO(NH2)2(s)和3 mol NO(g),容器内混合气体总物质的量随时间的变化如图所示。

①20min末,容器内N2的物质的量为
②a点时v正
(2)向恒温恒容的密闭容器中,加入一定量的CO(NH2)2(s)和NO(g),能够说明该反应达到平衡的是_______(填标号)。
| A.混合气体的密度不再改变 | B. |
| C.混合气体中,H2O的物质的量分数不再改变 | D.3v正(NO)=v逆(CO2) |
23-24高二上·河南·开学考试
类题推荐
已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)⇌2NO(g) ΔH1=+180kJ·mol-1
②2CO(g)+2NO(g)⇌N2(g)+2CO2(g) ΔH2
请回答下列问题:
(1)若已知CO的燃烧热即ΔH3=-283.5kJ·mol-1,则反应②的ΔH2=___________ kJ·mol-1。
(2)若在恒温恒容密闭容器中充入2molCO(g)和1molNO(g),发生反应②,下列选项中能说明反应已达到平衡状态的是___________(填标号)。
(3)CO和NO2也可反应,热化学方程式为2NO2(g)+4CO(g)⇌N2(g)+4CO2(g) ΔH4<0。T℃时,向2L恒容密闭容器中充入4.0molNO2和4.0molCO,测得相关数据如下:
①0~5min内,v正(CO2)=________ mol·L-1·min-1;该温度下反应的化学平衡常数K=________ (用分数表达)L·mol-1。
②其他条件不变,升高温度,NO2的平衡转化率___________ (填“增大”、“减小”或“不变”,下同),混合气体的密度___________ 。
③20min时,将容器改为恒温恒压且体积仍为2L,再向容器中通入0.4molCO、0.7molN2和0.4molCO2,此时v正___________ v逆(填“>”“<”或“=”)。
①N2(g)+O2(g)⇌2NO(g) ΔH1=+180kJ·mol-1
②2CO(g)+2NO(g)⇌N2(g)+2CO2(g) ΔH2
请回答下列问题:
(1)若已知CO的燃烧热即ΔH3=-283.5kJ·mol-1,则反应②的ΔH2=
(2)若在恒温恒容密闭容器中充入2molCO(g)和1molNO(g),发生反应②,下列选项中能说明反应已达到平衡状态的是___________(填标号)。
| A.CO和NO的物质的量之比不变 | B.该反应的化学平衡常数不变 |
| C.混合气体的压强保持不变 | D.v正(N2)=2v逆(CO) |
| 0min | 5min | 10min | 15min | 20min | |
| n(NO2)/mol | 4.0 | 3.4 | 3.12 | 3.0 | 3.0 |
| n(N2)/mol | 0 | 0.30 | 0.44 | 0.50 | 0.50 |
②其他条件不变,升高温度,NO2的平衡转化率
③20min时,将容器改为恒温恒压且体积仍为2L,再向容器中通入0.4molCO、0.7molN2和0.4molCO2,此时v正
CO和H2可作为能源和化工原料,应用十分广泛。常利用煤气化过程中生成的CO和H2来制备甲醇。

(1)请根据图示写出该反应的热化学方程式:_______________ ;图中使用催化剂曲线是_______ (填“a”或“b”)。
(2)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)的ΔH=______________ kJ/mol。
(3)反应CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
①从上表可以推断:此反应是__________ (填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为___________________ 。
(4)汽车排气管上的催化转化器发生如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
①能说明该反应达到平衡状态的是_____________ (填字母标号)。
A. 2v正(NO)=v逆(N2) B. 混合气体的平均相对分子质量保持不变
C. 气体总压强不再变化 D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5 min,生成了0.08 mol N2,则5 min内v(CO)=__________ mol/(L·min)。
③25 min时,物质浓度变化如图所示,则改变的条件可能是________ (填字母标号)。

A. 缩小容器体积 B. 增加NO的浓度
C. 降低温度 D. 升高温度

(1)请根据图示写出该反应的热化学方程式:
(2)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)的ΔH=
(3)反应CO(g)+H2O(g)
 H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为
(4)汽车排气管上的催化转化器发生如下反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:①能说明该反应达到平衡状态的是
A. 2v正(NO)=v逆(N2) B. 混合气体的平均相对分子质量保持不变
C. 气体总压强不再变化 D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5 min,生成了0.08 mol N2,则5 min内v(CO)=
③25 min时,物质浓度变化如图所示,则改变的条件可能是

A. 缩小容器体积 B. 增加NO的浓度
C. 降低温度 D. 升高温度
为防止氮的氧化物污染空气,可用活性炭或一氧化碳还原氮氧化物。
已知:①2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
②C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
③N2(g)+O2(g)=2NO(g) △H=+181kJ/mol
回答下列问题:
I.消除上述气体污染物可用CO与NO反应生成CO2和N2。请完成热化学方程式:2NO(g)+2CO(g) N2(g)+2CO2(g) △H=
N2(g)+2CO2(g) △H=___________ kJ/mol,为提高此反应中NO的转化率,下列措施可行的是___________ (填字母代号)。
A.增大压强 B.升高温度 C.使用催化剂 D.增大CO的浓度
II.向2L的恒容密闭容器中加入活性炭(足量)和2.0molNO,发生反应:2NO(g)+C(s) N2(g)+CO2(g);△H=-574.5kJ/mol;
N2(g)+CO2(g);△H=-574.5kJ/mol;
NO和N2的物质的量变化如下表所示:
(1)0~5min内,以CO2表示的该反应速率v(CO2)=___________ mol/(L·min),该条件下的平衡常数K=___________ 。
(2)下列说法能判断上述恒容密闭容器中的反应已达到化学平衡状态的是___________ 。
A.容器内气体密度不变
B.混合气体的平均相对分子质量保持不变
C.N2与CO2的压强之比保持不变
D.2v正(NO)=v逆(N2)
(3)第15min后,温度调整到T2,则T1___________ T2(填 “>”“<“或“=”)。
(4)若30min时,温度保持T2不变,向该容器中再加入该四种反应混合物各2.0mol,则此时反应___________ (填“正向“逆向”或“不”移动)。
已知:①2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
②C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
③N2(g)+O2(g)=2NO(g) △H=+181kJ/mol
回答下列问题:
I.消除上述气体污染物可用CO与NO反应生成CO2和N2。请完成热化学方程式:2NO(g)+2CO(g)
A.增大压强 B.升高温度 C.使用催化剂 D.增大CO的浓度
II.向2L的恒容密闭容器中加入活性炭(足量)和2.0molNO,发生反应:2NO(g)+C(s)
NO和N2的物质的量变化如下表所示:
| 物质的量浓度/mol/L | T1/℃ | T2/℃ | |||||
| 0 | 5min | 10min | 15min | 20min | 25min | 30min | |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.25 | 0.20 | 0.20 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.375 | 0.40 | 0.40 |
(2)下列说法能判断上述恒容密闭容器中的反应已达到化学平衡状态的是
A.容器内气体密度不变
B.混合气体的平均相对分子质量保持不变
C.N2与CO2的压强之比保持不变
D.2v正(NO)=v逆(N2)
(3)第15min后,温度调整到T2,则T1
(4)若30min时,温度保持T2不变,向该容器中再加入该四种反应混合物各2.0mol,则此时反应
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


