解答题-原理综合题 较易0.85 引用1 组卷155
雾霾中含有多种污染物,包括氮氧化物(NOx)、CO、SO2等。它们可以通过化学反应得到一定的消除或转化。
(1)氮硫的氧化物的转化:
已知:NO(g)+ O2(g)=NO2(g) ΔH1=-56.5 kJ·mol-1
O2(g)=NO2(g) ΔH1=-56.5 kJ·mol-1
2SO2(g)+O2(g)⇌2SO3(g) ΔH2=-196.6 kJ·mol-1
则:NO2(g)+SO2(g)⇌SO3(g)+NO(g) ΔH=___________ kJ·mol-1。
一定条件下,将NO2与SO2以一定比例置于恒温恒容的密闭容器中发生上述反应,下列能说明该反应达到平衡状态的有___________ 。
a.混合气体的密度不变 b.混合气体的颜色保持不变
c.SO3和NO的体积比保持不变 d.容器内的压强不再发生变化
(2)一定温度下,向某密闭容器中充入1 mol NO2,发生反应:2NO2(g)⇌N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示。
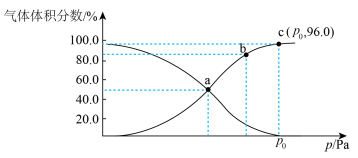
①a、b、c三点逆反应速率由大到小的顺序为___________ 。平衡时若保持压强、温度不变,再向体系中加入一定量的Ne,则平衡___________ 移动(填“正向”“逆向”或“不”)。
②a点时NO2的转化率为___________ (精确到小数点后一位),用平衡分压代替平衡浓度也可求出平衡常数Kp,则该温度下Kp=___________ Pa-1(可用p0的代数式表示)。
(3)已知在一定温度下的可逆反应N2O4(g)⇌2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=___________ k逆。
(1)氮硫的氧化物的转化:
已知:NO(g)+
2SO2(g)+O2(g)⇌2SO3(g) ΔH2=-196.6 kJ·mol-1
则:NO2(g)+SO2(g)⇌SO3(g)+NO(g) ΔH=
一定条件下,将NO2与SO2以一定比例置于恒温恒容的密闭容器中发生上述反应,下列能说明该反应达到平衡状态的有
a.混合气体的密度不变 b.混合气体的颜色保持不变
c.SO3和NO的体积比保持不变 d.容器内的压强不再发生变化
(2)一定温度下,向某密闭容器中充入1 mol NO2,发生反应:2NO2(g)⇌N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示。

①a、b、c三点逆反应速率由大到小的顺序为
②a点时NO2的转化率为
(3)已知在一定温度下的可逆反应N2O4(g)⇌2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=
23-24高二上·甘肃张掖·开学考试
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


 2NO2(g) ΔH1=-113 kJ·mol-1
2NO2(g) ΔH1=-113 kJ·mol-1 NO2(g)+NO(g),达到平衡后,t1时刻改变某一条件后,速率与时间的变化图象如图甲所示,下列有关说法正确的是
NO2(g)+NO(g),达到平衡后,t1时刻改变某一条件后,速率与时间的变化图象如图甲所示,下列有关说法正确的是



