解答题-工业流程题 适中0.65 引用2 组卷323
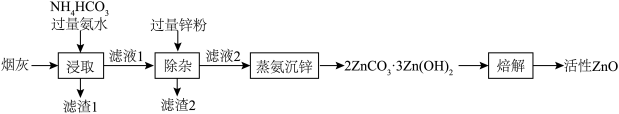
实验室用氨法浸出氧化锌烟尘制备活性 ,其主要实验流程如下:
,其主要实验流程如下:

(1)浸出。用一定浓度的管水和 配成的混合液浸取氧化锌烟尘,得到锌氨
配成的混合液浸取氧化锌烟尘,得到锌氨 浸出液。
浸出液。
① 元素基态原子的外围电子排布式为
元素基态原子的外围电子排布式为___________ ,位于元素周期表中的___________ 区。
②烟尘中的主要成分 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
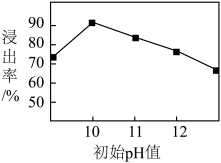
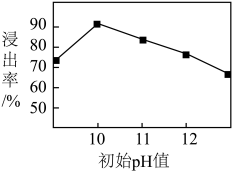
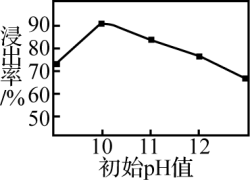
③锌元素的浸出率随浸出液初始 的变化关系如图所示。当浸出液初始
的变化关系如图所示。当浸出液初始 大于10时,浸出率随
大于10时,浸出率随 增大而减小的原因是
增大而减小的原因是___________ 。
(2)除杂。 等杂质也与氨水形成配合物存在于浸出后的滤液中,加入
等杂质也与氨水形成配合物存在于浸出后的滤液中,加入 粉可将它们置换除去。写出
粉可将它们置换除去。写出 粉和铜氨配合物反应的离子方程式
粉和铜氨配合物反应的离子方程式___________ 。
(3)蒸氨。加热时溶液中过量的氨和铵被蒸出,锌氨配合物最终以 沉淀形式从溶液中析出。该过程需保持恒温
沉淀形式从溶液中析出。该过程需保持恒温 ,可采取的加热方式为
,可采取的加热方式为___________ 。
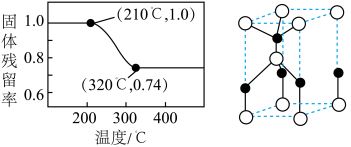
(4)焙解。已知 和
和 的分解温度分别为
的分解温度分别为 、
、 。实验室加热碱式碳酸锌
。实验室加热碱式碳酸锌 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。
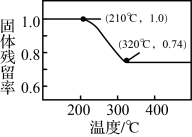
① 时,碱式碳酸锌分解产生的气态物质为
时,碱式碳酸锌分解产生的气态物质为___________ (填化学式)。
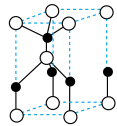
②经焙解得到的活性 晶胞结构如图所示。该晶胞中
晶胞结构如图所示。该晶胞中 原子的配位数为
原子的配位数为___________ 。

(1)浸出。用一定浓度的管水和
①
②烟尘中的主要成分
③锌元素的浸出率随浸出液初始

(2)除杂。
(3)蒸氨。加热时溶液中过量的氨和铵被蒸出,锌氨配合物最终以
(4)焙解。已知

①
②经焙解得到的活性

22-23高一下·江苏苏州·阶段练习
类题推荐
实验室用氨法浸出氧化锌烟尘制备活性ZnO,其主要实验流程如图:
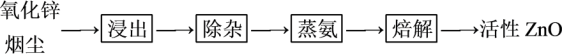
(1)浸出。用一定浓度的氨水和NH4HCO3配成的混合液浸取氧化锌烟尘,得到锌氨[Zn(NH3)4CO3]浸出液。
①烟尘中的主要成分ZnO发生反应的化学方程式为_______ 。
②锌元素的浸出率随浸出液初始pH的变化关系如图所示。当浸出液初始pH大于10时,浸出率随pH增大而减小的原因是_______ 。
(2)除杂。Cu2+、Pb2+等杂质也与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它们置换除去。写出Zn粉和铜氨配合物反应的离子方程式_______ 。
(3)蒸氨。加热时溶液中过量的氨和铵被蒸出,锌氨配合物最终以2ZnCO3·3Zn(OH)2沉淀形式从溶液中析出。该过程需保持恒温80℃,可采取的加热方式为_______ 。
(4)已知pH>11时,Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表是几种离子生成氢氧化物沉淀的pH:
设计以锌灰(主要成分为Zn和ZnO,杂质为Fe及其氧化物)为原料制备活性ZnO的实验方案:_______ 。(实验中可供选择的试剂:1.0 mol/L HNO3、1.0 mol/L H2SO4、1.0 mol/L NaOH、20%H2O2)
(5)取mg活性氧化锌样品,预处理后配成待测液,加入指示剂3、4滴,再加入适量六亚甲基四胺,用amol•L-1EDTA标准液进行滴定,消耗标准液VmL。已知:与1.0mLEDTA标准液[c(EDTA)=1.000mol•L-1]相当的以克表示的氧化锌质量为0.08139,则样品中氧化锌的质量分数为_______ (用代数式表示)。
(1)浸出。用一定浓度的氨水和NH4HCO3配成的混合液浸取氧化锌烟尘,得到锌氨[Zn(NH3)4CO3]浸出液。
①烟尘中的主要成分ZnO发生反应的化学方程式为
②锌元素的浸出率随浸出液初始pH的变化关系如图所示。当浸出液初始pH大于10时,浸出率随pH增大而减小的原因是

(2)除杂。Cu2+、Pb2+等杂质也与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它们置换除去。写出Zn粉和铜氨配合物反应的离子方程式
(3)蒸氨。加热时溶液中过量的氨和铵被蒸出,锌氨配合物最终以2ZnCO3·3Zn(OH)2沉淀形式从溶液中析出。该过程需保持恒温80℃,可采取的加热方式为
(4)已知pH>11时,Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表是几种离子生成氢氧化物沉淀的pH:
| 开始沉淀的pH | 沉淀完全的pH | |
| Zn2+ | 5.9 | 8.9 |
| Fe2+ | 5.8 | 8.8 |
| Fe3+ | 1.1 | 3.2 |
(5)取mg活性氧化锌样品,预处理后配成待测液,加入指示剂3、4滴,再加入适量六亚甲基四胺,用amol•L-1EDTA标准液进行滴定,消耗标准液VmL。已知:与1.0mLEDTA标准液[c(EDTA)=1.000mol•L-1]相当的以克表示的氧化锌质量为0.08139,则样品中氧化锌的质量分数为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网