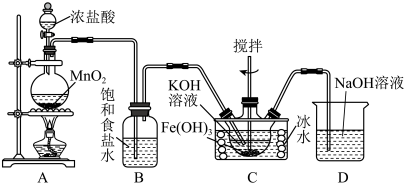
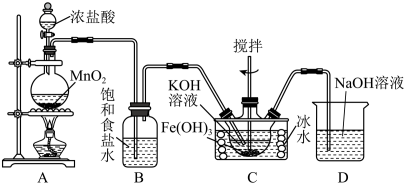
解答题-实验探究题 适中0.65 引用1 组卷127
以 作为铁源制备高铁酸钾(K2FeO4),可用于去除水体中的AS(Ⅲ)。已知:
作为铁源制备高铁酸钾(K2FeO4),可用于去除水体中的AS(Ⅲ)。已知: 微溶于水。在酸性或中性溶液中迅速氧化
微溶于水。在酸性或中性溶液中迅速氧化 产生
产生 ,在碱性溶液中较稳定。在
,在碱性溶液中较稳定。在 和
和 催化作用下发生分解。
催化作用下发生分解。
(1)制备高铁酸钾。向 和
和 混合溶液中加入
混合溶液中加入 ,过滤得到
,过滤得到 固体。
固体。
①制备 的化学方程式为
的化学方程式为___________ 。
②制备过程中 和
和 需过量的原因是
需过量的原因是___________ 。
③过滤所得的滤液中加入稀硫酸,产生 ,原因可能是:酸性条件下
,原因可能是:酸性条件下 氧化了
氧化了 ,还可能是
,还可能是___________ 。
(2)实验室可用间接碘量法测定含少量 杂质的
杂质的 样品的纯度:称取
样品的纯度:称取 样品溶于碱性KI溶液中,调节pH使混合液充分反应。用
样品溶于碱性KI溶液中,调节pH使混合液充分反应。用 的
的 标准溶液进行滴定,消耗
标准溶液进行滴定,消耗 标准溶液
标准溶液 。滴定时,发生反应的离子方程式:
。滴定时,发生反应的离子方程式: ;
; ,请计算
,请计算 样品的纯度:
样品的纯度:___________ (写出计算过程)。
(1)制备高铁酸钾。向
①制备
②制备过程中
③过滤所得的滤液中加入稀硫酸,产生
(2)实验室可用间接碘量法测定含少量
22-23高一下·江苏镇江·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网