解答题-原理综合题 适中0.65 引用1 组卷154
甲醇(CH3OH)是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:

(1)反应Ⅱ的
_______ 。
(2)反应Ⅲ的
_______ 0(填“<”或“>”),在_______ (填“较低温度”、“较高温度”或“任何温度”)下能够自发进行。
(3)恒温、恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是_______。
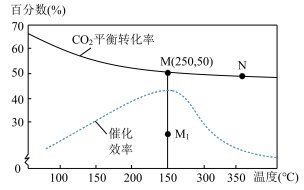
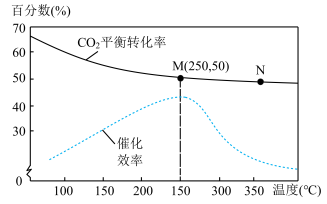
(4)对于反应Ⅰ,不同温度对 的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______。
的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______。
(5)若在1L密闭容器中充入3mol  和1mol
和1mol  发生反应Ⅰ,则图中M点时,产物甲醇的体积分数为
发生反应Ⅰ,则图中M点时,产物甲醇的体积分数为_______ ;该温度下,反应的平衡常数K=_______ (均保留3位有效数字)。
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
(1)反应Ⅱ的
(2)反应Ⅲ的
(3)恒温、恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是_______。
| A.混合气体的密度不再变化 |
| B.混合气体的平均相对分子质量不再变化 |
| C. |
| D.甲醇的百分含量不再变化 |

| A.其他条件不变,若不使用催化剂,则250℃时 |
| B.温度低于250℃,随温度升高甲醇的产率增大 |
| C.使用催化剂时,M点的正反应速率小于N点的正反应速率 |
| D.M点时平衡常数比N点时平衡常数大 |
23-24高三上·上海浦东新·开学考试
类题推荐
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g),ΔH1=-49.58kJ·mol-1
CH3OH(g)+H2O(g),ΔH1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g),ΔH2
CO(g)+H2O(g),ΔH2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g),ΔH3=-90.77kJ·mol-1
CH3OH(g),ΔH3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的ΔH2=___________ 。
(2)反应Ⅲ能够自发进行的条件是___________ 。(填“较低温度”“较高温度”或“任何温度”)。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是___________。
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是________。

(5)若在1 L密闭容器中充入2.5 molH2和1 molCO2发生反应I,则图中M点时,产物甲醇的体积分数为___________ ,该温度下反应的平衡常数K=___________ 。
(6)已知下列物质在20°C下的Ksp如下,试回答下列问题:
①向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时 =
=___________ 。
②测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是___________ 。
A.KBr B.KI C.K2S D.K2CrO4
反应Ⅰ:CO2(g)+3H2(g)
反应Ⅱ:CO2(g)+H2(g)
反应Ⅲ:CO(g)+2H2(g)
回答下列问题:
(1)反应Ⅱ的ΔH2=
(2)反应Ⅲ能够自发进行的条件是
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是___________。
| A.混合气体的密度不再变化 |
| B.混合气体的平均相对分子质量不再变化 |
| C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1 |
| D.甲醇的百分含量不再变化 |

| A.其他条件不变,若不使用催化剂,则250°C时CO2的平衡转化率可能位于M1 |
| B.温度低于250°C时,随温度升高甲醇的产率增大 |
| C.M点时平衡常数比N点时平衡常数大 |
| D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率 |
(6)已知下列物质在20°C下的Ksp如下,试回答下列问题:
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 | 2.0×10-12 |
②测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是
A.KBr B.KI C.K2S D.K2CrO4
能源、材料、环保、健康等是当今社会重要的研究主题,化学与这些主题密切相关,在其研究与应用中发挥着重要作用。甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应I: CO2(g)+ 3H2(g)⇌CH3OH(g)+H2O(g) △H1=- 49.58kJ·mol-1
反应II: CO2(g)+H2(g)⇌CO(g)+ H2O(g) △H2=+41.19kJ·mol-1
反应III: CO(g)+ 2H2(g)⇌CH3OH(g) △H3
回答下列问题:
(1)反应III的△H3=_______ 。
(2)恒温,恒容密闭容器中,对于反应I,下列说法中不能说明该反应达到化学平衡状态的是_______。
(3)对于反应I,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法正确的是_______。

(4)若在2L密闭容器中充入3 mol H2和1 mol CO2发生反应I,250℃时反应的平衡常数K=____ (列出计算式)。
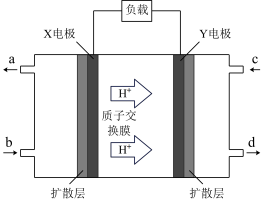
(5)甲醇燃料电池的工作原理如图所示,则Y电极为_______ (填“正极”或“负极”), X电极的电极反应式为_______ 。换膜若使用该电池完成铁制品镀银,当铁制品质量增加64.8g时,理论上消耗甲醇的质量为_______ g。

反应I: CO2(g)+ 3H2(g)⇌CH3OH(g)+H2O(g) △H1=- 49.58kJ·mol-1
反应II: CO2(g)+H2(g)⇌CO(g)+ H2O(g) △H2=+41.19kJ·mol-1
反应III: CO(g)+ 2H2(g)⇌CH3OH(g) △H3
回答下列问题:
(1)反应III的△H3=
(2)恒温,恒容密闭容器中,对于反应I,下列说法中不能说明该反应达到化学平衡状态的是_______。
| A.混合气体的密度不再变化 |
| B.混合气体的平均相对分子质量不再变化 |
| C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1。 |
| D.混合气体的压强不再变化 |

| A.其他条件不变,若不使用催化剂,则250°C时CO2的平衡转化率可能位于M1 |
| B.温度低于250°C时,随温度升高甲醇的产率增大 |
| C.M点时平衡常数比N点时平衡常数大 |
| D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率。 |
(5)甲醇燃料电池的工作原理如图所示,则Y电极为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网