解答题-原理综合题 适中0.65 引用1 组卷102
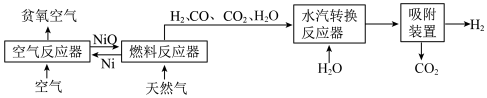
自热化学链重整制氢 CLR(a)工艺的原理如图所示:
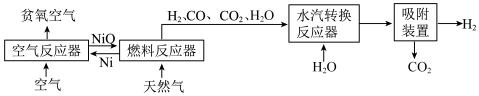
回答下列问题:
(1)25℃、101kPa 时,5.9gNi 与足量 O2反应生成 NiO 放出 47.2kJ 的热量,则在“空气反应器” 中发生反应的热化学方程式为___________ 。
(2)“燃料反应器”中发生的部分反应有:
(I)CO(g)+NiO(s)=CO2(g)+Ni(s) ΔH1=-47.0kJ/mol 平衡常数 K1
(II)CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s) ΔH2=+137.7kJ/mol 平衡常数 K2
(III) CH4(g)+3CO2(g)=4CO(g)+2H2O(g) ΔH3=akJ/mol 平衡常数 K3
①CO2的电子式:___________ 。
②K1、K2、K3之间的关系是:___________ ;
③在___________ (填“高温”或“低温”)情况下有利于反应Ⅲ的自发进行。
(3)“水汽转换反应器”中发生的反应为CO(g)+ H2O(g)=CO2(g)+H2(g),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在 t℃时进行转换,水汽转换反应器中达平衡时 CO、H2O、H2、CO2浓度之比为1:x:3:1,则该反应的平衡常数 K=___________ 。
(4)甲烷制氢传统工艺有水蒸气重整部分氧化重整以及联合重整等,CLR(a)工艺重整是一种联合重整,涉及反应的热化学方程式如下:
CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+192kJ/mol
CH4(g)+O2(g)=CO2(g)+2H2(g) ΔH=-768kJ/mol
水蒸气重整反应: 部分氧化重整反应:
①采用水蒸气重整的优点是:___________ ;
②上述两个反应的缺点之一是在制取氢气的同时产生大量温室气体 CO2,若用 NaOH 溶液来吸收 CO2,写出反应的离子方程式:___________ ;
③若上述两个反应在保持自热条件下(假设无热量损失),理论上 2 molCH4至多可获得 H2的物质的量为___________ (结果保留 1 位小数)。

回答下列问题:
(1)25℃、101kPa 时,5.9gNi 与足量 O2反应生成 NiO 放出 47.2kJ 的热量,则在“空气反应器” 中发生反应的热化学方程式为
(2)“燃料反应器”中发生的部分反应有:
(I)CO(g)+NiO(s)=CO2(g)+Ni(s) ΔH1=-47.0kJ/mol 平衡常数 K1
(II)CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s) ΔH2=+137.7kJ/mol 平衡常数 K2
(III) CH4(g)+3CO2(g)=4CO(g)+2H2O(g) ΔH3=akJ/mol 平衡常数 K3
①CO2的电子式:
②K1、K2、K3之间的关系是:
③在
(3)“水汽转换反应器”中发生的反应为CO(g)+ H2O(g)=CO2(g)+H2(g),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在 t℃时进行转换,水汽转换反应器中达平衡时 CO、H2O、H2、CO2浓度之比为1:x:3:1,则该反应的平衡常数 K=
(4)甲烷制氢传统工艺有水蒸气重整部分氧化重整以及联合重整等,CLR(a)工艺重整是一种联合重整,涉及反应的热化学方程式如下:
CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+192kJ/mol
CH4(g)+O2(g)=CO2(g)+2H2(g) ΔH=-768kJ/mol
水蒸气重整反应: 部分氧化重整反应:
①采用水蒸气重整的优点是:
②上述两个反应的缺点之一是在制取氢气的同时产生大量温室气体 CO2,若用 NaOH 溶液来吸收 CO2,写出反应的离子方程式:
③若上述两个反应在保持自热条件下(假设无热量损失),理论上 2 molCH4至多可获得 H2的物质的量为
21-22高二上·重庆大足·阶段练习
类题推荐
碳及其化合物在生产、生活中广泛存在。请回答下列问题:
I.已知甲烷隔绝空气在不同温度下有可能发生如下两个裂解反应:
①CH4(g)→C(s)+2H2(g) ΔH(298K)=+74.8kJ/mol,ΔS(298K)=+80.7J/(mol·K)
②2CH4(g) →C2H2(g)+3H2(g) ΔH(298K)=+376.4kJ/mol,ΔS(298K)=+220.2J/(mol·K)
某同学为了得到用天然气制取炭黑的允许温度范围和最佳温度,在图书馆查到如下热力学数据:
(1)反应①属于___________ (填“高温”或“低温”)自发反应。反应①自发进行是由___________ (填“焓变”或“熵变”)决定的。
(2)计算反应②能自发进行的温度范围(写出计算过程)___________ 。
(3)已知:①C(s)+CO2(g) 2CO(g) ΔH1=akJ/mol 平衡常数K1
2CO(g) ΔH1=akJ/mol 平衡常数K1
②CO(g)+H2O(g) H2(g)+CO2(g) ΔH2=bkJ/mol 平衡常数K2
H2(g)+CO2(g) ΔH2=bkJ/mol 平衡常数K2
③C(s)+H2O(g) H2(g)+CO(g) ΔH3 平衡常数K3
H2(g)+CO(g) ΔH3 平衡常数K3
则K1、K2、K3之间的关系是K3=___________ 。
(4)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气2L密闭容器中,发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g)。该反应平衡常数随温度的变化如表所示:该反应的正反应方向是
H2(g)+CO2(g)。该反应平衡常数随温度的变化如表所示:该反应的正反应方向是___________ 反应(填“吸热”或“放热”)。
(5)若在500℃时进行,设起始时CO和H2O起始浓度均为0.02mol/L,在该条件下,CO的平衡转化率为___________ 。
(6)保持温度500℃不变,某一体积为1L的密闭容器中加入该反应中四种物质各2mol,则此时反应___________ 移动(填“正向”、“逆向”或“不”),理由是:___________ 。
I.已知甲烷隔绝空气在不同温度下有可能发生如下两个裂解反应:
①CH4(g)→C(s)+2H2(g) ΔH(298K)=+74.8kJ/mol,ΔS(298K)=+80.7J/(mol·K)
②2CH4(g) →C2H2(g)+3H2(g) ΔH(298K)=+376.4kJ/mol,ΔS(298K)=+220.2J/(mol·K)
某同学为了得到用天然气制取炭黑的允许温度范围和最佳温度,在图书馆查到如下热力学数据:
(1)反应①属于
(2)计算反应②能自发进行的温度范围(写出计算过程)
(3)已知:①C(s)+CO2(g)
②CO(g)+H2O(g)
③C(s)+H2O(g)
则K1、K2、K3之间的关系是K3=
(4)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气2L密闭容器中,发生如下反应:CO(g)+H2O(g)
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数/K | 9.94 | 9 | 1 |
(6)保持温度500℃不变,某一体积为1L的密闭容器中加入该反应中四种物质各2mol,则此时反应
工业产生的废气COx、NOx、SOx对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为890kJ/mol;1mol 水蒸气变成液态水放热44k;N2与O2反应生成NO 的过程如下:
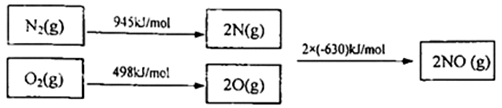
则CH4(g) +4NO(g)=2N2 (g) +CO2(g) +2H2O(g)△H=_________ 。
(2)汽车尾气中含有CO 和NO,某研究小组利用反应:
2CO(g)+2NO(g) N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
①0~2 s 内用N2表示的化学反应速率为______ 该温度下,反应的平衡常数K1________ 。
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1___ K2 (填“>”、“<”或“=”),原因是____________________ 。
(3)向甲、乙两个容积均为1L 的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2molSO2、1molO2,乙充入1molSO2 、0.5molO2),发生反应:2SO2(g)+O2(g) 2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
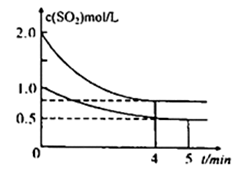
下列说法正确的是_________ (填标号)。
①放出的热量Q:Q(甲)>2Q (乙)
②体系总压强p: p (甲) >2p(Z)
③甲容器达到化学平衡时,其化学平衡常数为4
④保持其他条件不变,若起始时向乙中充入0.4 molSO2、0.2mol O2、0.4 molSO3,则此时v(正)>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2 可得到多种燃料,其原理如图所示。
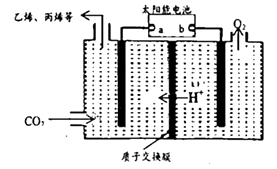
①该工艺中能量转化方式主要有___________________ 。
②电解时,生成乙烯的电极反应式是__________________________ 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4 mol / L,则生成沉淀所需CaCl2溶液的最小浓度为_______ 。
(1)已知甲烷的燃烧热为890kJ/mol;1mol 水蒸气变成液态水放热44k;N2与O2反应生成NO 的过程如下:

则CH4(g) +4NO(g)=2N2 (g) +CO2(g) +2H2O(g)△H=
(2)汽车尾气中含有CO 和NO,某研究小组利用反应:
2CO(g)+2NO(g)
 N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)10-3mol/L | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1
(3)向甲、乙两个容积均为1L 的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2molSO2、1molO2,乙充入1molSO2 、0.5molO2),发生反应:2SO2(g)+O2(g)
 2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
下列说法正确的是
①放出的热量Q:Q(甲)>2Q (乙)
②体系总压强p: p (甲) >2p(Z)
③甲容器达到化学平衡时,其化学平衡常数为4
④保持其他条件不变,若起始时向乙中充入0.4 molSO2、0.2mol O2、0.4 molSO3,则此时v(正)>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2 可得到多种燃料,其原理如图所示。

①该工艺中能量转化方式主要有
②电解时,生成乙烯的电极反应式是
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4 mol / L,则生成沉淀所需CaCl2溶液的最小浓度为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网