解答题-实验探究题 适中0.65 引用2 组卷475
草酸亚铁晶体(FeC2O4·2H2O,难溶于水)是电池磷酸铁锂正极材料所需的主要原材料。某同学在实验室,利用废铁屑制备草酸亚铁晶体(FeC2O4·2H2O)。回答下列问题:
(1)利用废铁屑制备硫酸亚铁溶液。废铁屑在使用前需要用热的饱和碳酸钠溶液进行洗涤,目的是___________ ;为了防止硫酸亚铁变质,制备过程中应采取的措施是___________ 。
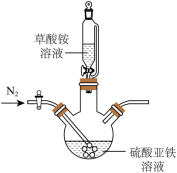
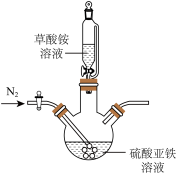
(2)草酸亚铁晶体制备,实验装置如图所示。___________ 。
②实验过程中不断通入N2,其目的除了提供无氧环境,另一个目的是___________ (结合实验装置回答)。
③反应完全后,用蒸馏水和无水乙醇多次洗涤,进行固液分离,在60℃下干燥12h,得到淡黄色的草酸亚铁晶体产品。检验草酸亚铁晶体洗涤干净的方法是___________ ;写出制备草酸亚铁晶体的离子方程式:___________ 。
(3)产品中FeC2O4·2H2O的质量分数测定[假设产品中杂质仅为FeSO4和(NH4)2SO4]
Ⅰ.将准确称量的ag草酸亚铁晶体样品置于250mL锥形瓶内,加入适量 的H2SO4溶解,加热至70℃左右,立即用浓度为
的H2SO4溶解,加热至70℃左右,立即用浓度为 的高锰酸钾标准溶液滴定至终点,重复2~3次,平均消耗高锰酸钾溶液bmL;
的高锰酸钾标准溶液滴定至终点,重复2~3次,平均消耗高锰酸钾溶液bmL;
Ⅱ.向上述滴定混合液中加入适量的Zn粉和过量的 的H2SO4溶液,煮沸(不含Fe3+),继续用
的H2SO4溶液,煮沸(不含Fe3+),继续用 的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液cmL。
的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液cmL。
①步骤Ⅱ中检验溶液不含Fe3+的操作:取一滴煮沸后的溶液滴入装有___________ (填化学式)溶液的试管中,若___________ ,则说明溶液不含Fe3+。
②产品中FeC2O4·2H2O的质量分数为___________ %(用含a、b、c的式子表示)。
已知 。
。
(1)利用废铁屑制备硫酸亚铁溶液。废铁屑在使用前需要用热的饱和碳酸钠溶液进行洗涤,目的是
(2)草酸亚铁晶体制备,实验装置如图所示。
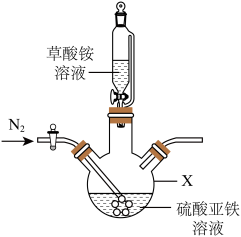
②实验过程中不断通入N2,其目的除了提供无氧环境,另一个目的是
③反应完全后,用蒸馏水和无水乙醇多次洗涤,进行固液分离,在60℃下干燥12h,得到淡黄色的草酸亚铁晶体产品。检验草酸亚铁晶体洗涤干净的方法是
(3)产品中FeC2O4·2H2O的质量分数测定[假设产品中杂质仅为FeSO4和(NH4)2SO4]
Ⅰ.将准确称量的ag草酸亚铁晶体样品置于250mL锥形瓶内,加入适量
Ⅱ.向上述滴定混合液中加入适量的Zn粉和过量的
①步骤Ⅱ中检验溶液不含Fe3+的操作:取一滴煮沸后的溶液滴入装有
②产品中FeC2O4·2H2O的质量分数为
已知
2023·河北·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网