解答题-结构与性质 适中0.65 引用2 组卷287
碳材料在生活中占有重要地位。
请回答:
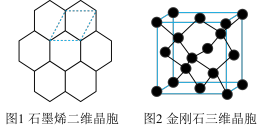
(1)下列说法正确的是 。
(2)图 1 中 C—C 键键长为 apm,则石墨烯的密度ρ=______________ g/cm2 (用含 a 式子表示,阿伏伽德罗常数为 NA)
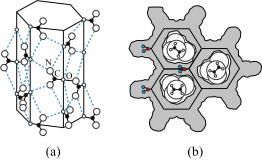
(3)尿素[(NH2)2CO]可以与正烷烃(n~CmH2m+2,m≥8)形成超分子包合物。尿素中各种元素的电负性由大到小的顺序________________ ,尿素分子通过______________________ 氢键(写出具体形式)
有序地组合成具有蜂窝状六角形通道结构的接受体,如(a)所示。正烷烃分子作为底物填入到通道之中,图(b)示出垂直于通道截面的结构。该超分子包合物能稳定存在的原因是_________________________ 。
请回答:

(1)下列说法正确的是 。
| A.石墨烯碳采用 sp2杂化,金刚石 VSPRE 模型为正四面体形 |
| B.多层石墨烯和金刚石均为共价型晶体 |
| C.1mol 石墨烯与金刚石中,σ键键数之比为 3:4 |
| D.石墨烯中 C—C 键键能较金刚石大,故石墨烯的内能更高 |
(3)尿素[(NH2)2CO]可以与正烷烃(n~CmH2m+2,m≥8)形成超分子包合物。尿素中各种元素的电负性由大到小的顺序
有序地组合成具有蜂窝状六角形通道结构的接受体,如(a)所示。正烷烃分子作为底物填入到通道之中,图(b)示出垂直于通道截面的结构。该超分子包合物能稳定存在的原因是

2023·浙江绍兴·二模
类题推荐
硼、碳、氮、磷、硫等元素形成的单质和化合物在生活、生产中有重要的用途。
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是___________ (填字母)。
A. B.
B.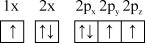
C.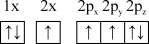 D.
D.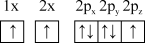
(2)氢、硼、碳、硫四元素的电负性由大到小的顺序为___________
(3)(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为___________ 。其σ键分别为___________ 型σ键。
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为___________

(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和对应金属阳离子的半径。随着金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高,原因是___________
(6)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性 (晶体结构如图)。
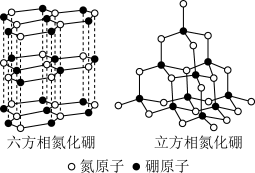
①关于这两种晶体的说法,不正确的是___________ (填字母)。
a.两种晶体均为分子晶体
b.两种晶体中的B﹣N键均为共价键
c.六方相氮化硼层间作用力小,所以质地软
d.立方相氮化硼含有σ键和π键,所以硬度大
②六方相氮化硼晶体其结构与石墨相似却不导电,原因是___________
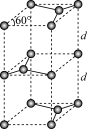
(7)石墨的晶胞结构如图所示。已知石墨的密度为ρg·cm-3,C-C键的键长为r cm,NA为阿伏加德罗常数的值,则石墨晶体的层间距d=___________ cm。
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是
A.
 B.
B.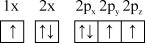
C.
 D.
D.
(2)氢、硼、碳、硫四元素的电负性由大到小的顺序为
(3)(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为

(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和对应金属阳离子的半径。随着金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高,原因是
| 碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 金属阳离子半径/pm | 66 | 99 | 112 | 135 |

①关于这两种晶体的说法,不正确的是
a.两种晶体均为分子晶体
b.两种晶体中的B﹣N键均为共价键
c.六方相氮化硼层间作用力小,所以质地软
d.立方相氮化硼含有σ键和π键,所以硬度大
②六方相氮化硼晶体其结构与石墨相似却不导电,原因是
(7)石墨的晶胞结构如图所示。已知石墨的密度为ρg·cm-3,C-C键的键长为r cm,NA为阿伏加德罗常数的值,则石墨晶体的层间距d=

物质的结构决定物质的性质。请回答下列问题:
(1)下列有关物质结构与性质的说法中错误的有_______ (填标号)。
A.酸性强弱:三氟乙酸>三氯乙酸>乙酸
B.C2H4分子中的H原子与C原子之间形成s-sp2σ键
C.价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数
D.H2S和NH3均是价层电子对数为4的极性分子,且H2S分子的键角较小
E.冰属于分子晶体,其中的氢键可以表示为O- H …O,具有“分子密堆积”特征
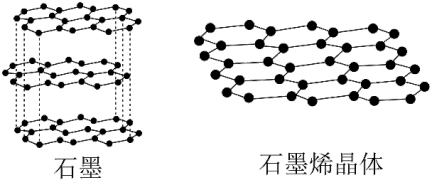
(2)石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体(见图)。从石墨中剥离出石墨烯需要破坏的作用力是_______ (从以下选项中选择,下同),石墨在一定条件下可转化为金刚石,转化过程中破坏了_______
A.离子键 B.金属键 C.范德华力 D.氢键 E.极性共价键 F.非极性共价键
12g石墨中由碳原子连接成的六元环的物质的量约为_______ mol。
(3)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”。下列物质中存在“离域π键”的是_______(填标号)。
(4)TiCl4与SiCl4互为等电子体。SiCl4可以与N-甲基咪唑
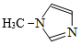
 发生反应。
发生反应。
①TiCl4分子的空间构型为_______ 。
②N-甲基咪唑分子中碳原子的杂化轨道类型为_______ ,C、N、Si的电负性由大到小的顺序为_______ ,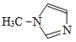 中的大π键可表示为:
中的大π键可表示为:_______ 。( ,a为参与形成大π键的原子数,b为参与形成大π键的电子数)
,a为参与形成大π键的原子数,b为参与形成大π键的电子数)
(5)硅的含氧化合物都以硅氧四面体(SiO )作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为
)作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为_______ 。在无限长链的硅酸根离子中硅原子与氧原子个数比为_______ 。
(1)下列有关物质结构与性质的说法中错误的有
A.酸性强弱:三氟乙酸>三氯乙酸>乙酸
B.C2H4分子中的H原子与C原子之间形成s-sp2σ键
C.价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数
D.H2S和NH3均是价层电子对数为4的极性分子,且H2S分子的键角较小
E.冰属于分子晶体,其中的氢键可以表示为O- H …O,具有“分子密堆积”特征
(2)石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体(见图)。从石墨中剥离出石墨烯需要破坏的作用力是

A.离子键 B.金属键 C.范德华力 D.氢键 E.极性共价键 F.非极性共价键
12g石墨中由碳原子连接成的六元环的物质的量约为
(3)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”。下列物质中存在“离域π键”的是_______(填标号)。
| A.苯 | B.三氧化硫 | C.四氯化碳 | D.环己烷 |


 发生反应。
发生反应。①TiCl4分子的空间构型为
②N-甲基咪唑分子中碳原子的杂化轨道类型为
 中的大π键可表示为:
中的大π键可表示为:(5)硅的含氧化合物都以硅氧四面体(SiO
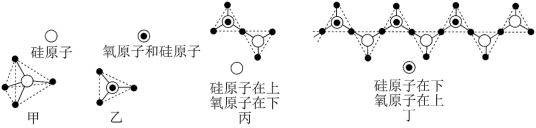
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



