解答题-原理综合题 适中0.65 引用1 组卷132
我国力争于2030年前实现碳达峰,2060年前实现碳中和。 催化加氢合成二甲醚是一种实现“碳中和”理想的
催化加氢合成二甲醚是一种实现“碳中和”理想的 转化方法。该过程中涉及的反应如下:
转化方法。该过程中涉及的反应如下:
主反应:

副反应:

回答下列问题:
(1)主反应通过以下步骤来实现:
I.

II.

则主反应的
_______  。
。
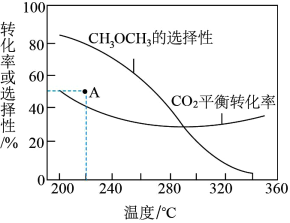
(2)在恒压、 和
和 的起始量一定时,
的起始量一定时, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如下图所示,
的选择性随温度的变化如下图所示, 的选择性
的选择性 。
。 平衡转化率随温度升高而增大的原因是
平衡转化率随温度升高而增大的原因是_______
②420℃时,在催化剂作用下 与
与 反应一段时间后,测得
反应一段时间后,测得 的选择性约为50%。不改变反应时间,一定能提高
的选择性约为50%。不改变反应时间,一定能提高 选择性的措施有
选择性的措施有_______ (填标号)。
A.升高温度 B.增大压强 C.增大 D.更换适宜的催化剂
D.更换适宜的催化剂
(3)在温度为543K。原料组成为 、初始总压为4MPa恒容密闭容器中进行反应,体系达到平衡时
、初始总压为4MPa恒容密闭容器中进行反应,体系达到平衡时 的转化率为30%,二甲醚的选择性为50%,则氢气的转化率
的转化率为30%,二甲醚的选择性为50%,则氢气的转化率
_______ ;主反应的压强平衡常数
_______ (列出计算式)。
(4)二甲醚直接燃料电池具有启动快、效率高、能量密度大等优点。若电解质溶液呈碱性,二甲醚直接燃料电池的负极反应为_______ 。
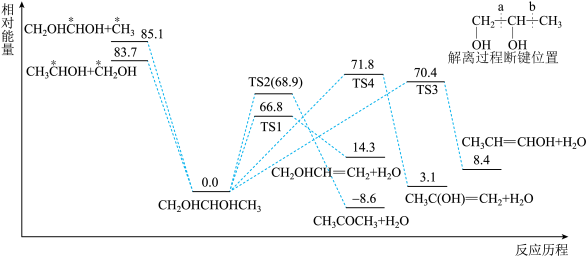
(5)1,2-丙二醇( )单分子解离反应相对能量如图所示,路径包括碳碳键断裂解离和脱水过程。从能量的角度分析,TS1、TS2、TS3、TS4四种路径中
)单分子解离反应相对能量如图所示,路径包括碳碳键断裂解离和脱水过程。从能量的角度分析,TS1、TS2、TS3、TS4四种路径中_______ 路径的速率最慢。
主反应:
副反应:
回答下列问题:
(1)主反应通过以下步骤来实现:
I.
II.
则主反应的
(2)在恒压、
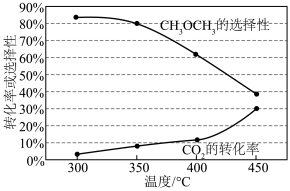
②420℃时,在催化剂作用下
A.升高温度 B.增大压强 C.增大
(3)在温度为543K。原料组成为
(4)二甲醚直接燃料电池具有启动快、效率高、能量密度大等优点。若电解质溶液呈碱性,二甲醚直接燃料电池的负极反应为
(5)1,2-丙二醇(
23-24高三上·湖北武汉·开学考试
类题推荐
中国提出要实现“二氧化碳排放力争于2030年前达到峰值,争取在2060年前实现碳中和”的目标,二氧化碳的资源化利用对实现碳中和目标具有促进作用。
甲醇是一种可再生能源,由 制备甲醇可能涉及的反应如下:
制备甲醇可能涉及的反应如下:
反应I:

反应II:

反应III:

已知部分化学键键能如表:
回答下列问题:
(1)反应I自发趋势是___________。
(2)在一密闭容器中充入 和
和 ,分别在
,分别在 、
、 、
、 压强下进行反应,测得
压强下进行反应,测得 的平衡转化率随温度的变化如图所示,
的平衡转化率随温度的变化如图所示, 温度后,反应主要以
温度后,反应主要以___________ (填反应I、反应II或反应III)为主。为了提高 生成
生成 的平衡转化率,同时减少反应III的发生,可采取的措施是
的平衡转化率,同时减少反应III的发生,可采取的措施是___________ 。
(3)在一定条件下,向体积为 的恒容密闭容器中通入
的恒容密闭容器中通入 和
和 ,假设仅发生反应I,测得
,假设仅发生反应I,测得 和
和 的物质的量浓度随时间的变化如图所示。
的物质的量浓度随时间的变化如图所示。
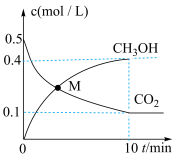
① 内,氢气的平均反应速率为
内,氢气的平均反应速率为___________ 。
②下列叙述中一定能说明该反应达到平衡状态的是___________ 。
A.化学反应速率关系:
B.容器内混合气体的密度不再改变
C.单位时间内,每断裂2个C=O键,同时断裂3个O—H键
D.容器内混合气体的平均摩尔质量不再改变
(4)加热锅炉时,水中的 可以先转化为
可以先转化为 ,然后转化为
,然后转化为 。已知:
。已知: 在80℃时的平衡常数为K,水的离子积为
在80℃时的平衡常数为K,水的离子积为 ,碳酸的第一级和第二级电离常数分别为
,碳酸的第一级和第二级电离常数分别为 和
和 ,则该温度下
,则该温度下
___________ (用相关常数表示)。
(5)二甲醚 直接燃料电池具有启动快、效率高、能量密度大等优点。若电解质溶液呈碱性、二甲醚直接燃料电池的负极反应为
直接燃料电池具有启动快、效率高、能量密度大等优点。若电解质溶液呈碱性、二甲醚直接燃料电池的负极反应为___________ 。
甲醇是一种可再生能源,由
反应I:
反应II:
反应III:
已知部分化学键键能如表:
| 化学键 | H—H | O—H | C—H | C—O | C=O |
| 键能 | 436 | 463 | 414 | 326 | 803 |
(1)反应I自发趋势是___________。
| A.高温自发 | B.低温自发 |
| C.任意温度下自发 | D.任意温度下非自发 |
(2)在一密闭容器中充入

(3)在一定条件下,向体积为

①
②下列叙述中一定能说明该反应达到平衡状态的是
A.化学反应速率关系:
B.容器内混合气体的密度不再改变
C.单位时间内,每断裂2个C=O键,同时断裂3个O—H键
D.容器内混合气体的平均摩尔质量不再改变
(4)加热锅炉时,水中的
(5)二甲醚
我国提出力争2060年前实现碳中和,以CO2为原料催化加氢制备甲醇具有较好的发展前景。已知:
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.5kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.5kJ•mol-1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+40.9kJ•mol-1
CO(g)+H2O(g) △H2=+40.9kJ•mol-1
Ⅲ.CO(g)+2H2(g) CH3OH(g) △H3
CH3OH(g) △H3
回答下列问题:
(1)反成I在______ (填“高温”“低温”或“任何温度”)条件下能够自发进行,反应Ⅲ的△H3=______ kJ•mol-1。
(2)将CO2和H2按n(CO2)∶n(H2)=1∶3通入密闭容器中发生反应I和反应Ⅱ,测得不同温度下CO2的平衡转化率以及CH3OH、CO选择性的变化如图所示(选择性为目标产物的物质的量在转化的CO2的总物质的量中的比率)。
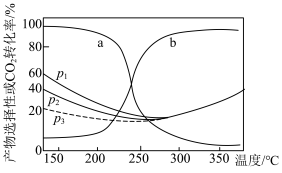
①根据图像指出CH3OH的选择性曲线为_______ (填“a”或“b”)。
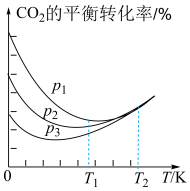
②不同压强下,CO2的平衡转化率如图所示,则p1、p2、p3由大到小的顺序_______ 。
③T>350℃时,p1、p2、p3三条曲线接近重合的原因是______ 。
④T℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OH的选择性为50%;保持投料比、反应时间和温度不变,一定能提高CH3OH选择性的措施有_______ (写出一种即可)。
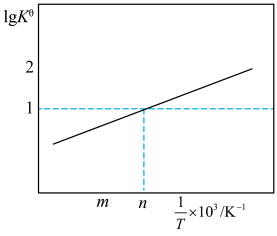
(3)已知:对于反应,dD(g)+eE(g) gG(g)+hH(g),pG、pH、pD、pE为各组分的平衡分压,Kθ=
gG(g)+hH(g),pG、pH、pD、pE为各组分的平衡分压,Kθ= ,其中pθ=100kPa,分压=总压×该组分物质的量分数。
,其中pθ=100kPa,分压=总压×该组分物质的量分数。
①则图为反应______ (填“Ⅱ”或“Ⅲ”)的lgKn随 (n>m)的变化关系。
(n>m)的变化关系。
②在图中n点对应温度下、原料组成为n(CO2)∶n(H2)=1∶3、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时CO的分压为10kPa,CH3OH的分压为6.25kPa,H2的平衡转化率为______ 。
(4)CO2催化加氢制甲醇在不同催化剂下的反应机理如图所示,(*表示催化剂表面的吸附位,如CO*表示吸附于催化剂表面的CO)

下列说法正确的是______ 。
I.CO2(g)+3H2(g)
Ⅱ.CO2(g)+H2(g)
Ⅲ.CO(g)+2H2(g)
回答下列问题:
(1)反成I在
(2)将CO2和H2按n(CO2)∶n(H2)=1∶3通入密闭容器中发生反应I和反应Ⅱ,测得不同温度下CO2的平衡转化率以及CH3OH、CO选择性的变化如图所示(选择性为目标产物的物质的量在转化的CO2的总物质的量中的比率)。

①根据图像指出CH3OH的选择性曲线为
②不同压强下,CO2的平衡转化率如图所示,则p1、p2、p3由大到小的顺序
③T>350℃时,p1、p2、p3三条曲线接近重合的原因是
④T℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OH的选择性为50%;保持投料比、反应时间和温度不变,一定能提高CH3OH选择性的措施有
(3)已知:对于反应,dD(g)+eE(g)
①则图为反应
②在图中n点对应温度下、原料组成为n(CO2)∶n(H2)=1∶3、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时CO的分压为10kPa,CH3OH的分压为6.25kPa,H2的平衡转化率为

(4)CO2催化加氢制甲醇在不同催化剂下的反应机理如图所示,(*表示催化剂表面的吸附位,如CO*表示吸附于催化剂表面的CO)

下列说法正确的是
| A.Cu-ZnO@SiO2催化剂中Cu+抑制了CO*的解吸附,从而抑制CO的生成 |
| B.Cu-ZnO@SiO2催化剂主要通过HCOO*路径加氢生成甲醇 |
| C.增大流速,原料气与催化剂碰撞机会多,甲醇产率一定增加 |
| D.随着温度升高,有利于CO2,在催化剂表而反应,平衡转化率增大 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网