解答题-原理综合题 较难0.4 引用1 组卷196
研究氮氧化物的性质具有重要的意义。
(1)NO可以催化 与
与 的反应:
的反应:
反应Ⅰ.
 kJ/mol
kJ/mol
反应Ⅱ.
 kJ/mol
kJ/mol
①下列说法正确的是:_____ 。
A.高温下有利于反应I的自发进行
B.反应Ⅱ的 对该反应的自发性影响不大
对该反应的自发性影响不大
C.恒温恒容下加入一定量 与
与 ,若容器内压强没有明显变化,说明不加催化剂时,
,若容器内压强没有明显变化,说明不加催化剂时, 与
与 的反应不能自发进行
的反应不能自发进行
D.NO催化下,一定量 与
与 反应一段时间后,升高温度,
反应一段时间后,升高温度, 的体积分数可能变大
的体积分数可能变大
②据报道,瑞典某工厂利用上述反应制取硫酸。在合成 时,向反应容器中适时通入冷激气(冷的原料气),其作用是
时,向反应容器中适时通入冷激气(冷的原料气),其作用是_____ 。
(2)密闭容器中加入一定量 和
和 ,发生反应Ⅱ(忽略其它反应)。保持常压条件,经过相同时间,测得
,发生反应Ⅱ(忽略其它反应)。保持常压条件,经过相同时间,测得 的体积分数随温度的变化如图所示:
的体积分数随温度的变化如图所示:
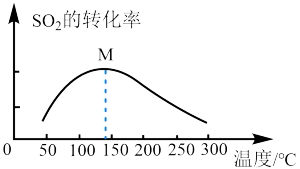
①由图可知,在M点之前,反应中 的体积分数随温度升高而减小,其原因为:
的体积分数随温度升高而减小,其原因为:_____ 。
②250℃和常压下,等物质的量的 和
和 反应后,测得平衡时NO的物质的量分数为40%,则该反应的物质的量分数平
反应后,测得平衡时NO的物质的量分数为40%,则该反应的物质的量分数平 的转化率平衡常数
的转化率平衡常数
_____ 。( 是用平衡时物质的量分数代替平衡浓度计算)保持上述条件不变,提高原料中
是用平衡时物质的量分数代替平衡浓度计算)保持上述条件不变,提高原料中 的比例,使平衡时
的比例,使平衡时 的产率为90%。则
的产率为90%。则 和
和 的投料比(即起始时加入的物质的量之比)为
的投料比(即起始时加入的物质的量之比)为_____ 。
(3)在一定温度下,一定量 分解成氮气和氧气,同时释放出热量。分解的部分实验数据如下表。反应一段时间后,只改变如下一个条件。下列说法正确的是:_____。
分解成氮气和氧气,同时释放出热量。分解的部分实验数据如下表。反应一段时间后,只改变如下一个条件。下列说法正确的是:_____。
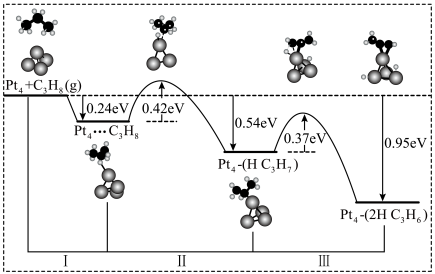
(4)以固体催化剂催化CO还原NO生成 和
和 气体,反应历程如下(*表示吸附态),
气体,反应历程如下(*表示吸附态),
请补充完整。
化学吸附: ;
;
表面反应: ;
;_____ :
 ;
;_____ 。
脱附: ;
;
(1)NO可以催化
反应Ⅰ.
反应Ⅱ.
①下列说法正确的是:
A.高温下有利于反应I的自发进行
B.反应Ⅱ的
C.恒温恒容下加入一定量
D.NO催化下,一定量
②据报道,瑞典某工厂利用上述反应制取硫酸。在合成
(2)密闭容器中加入一定量

①由图可知,在M点之前,反应中
②250℃和常压下,等物质的量的
(3)在一定温度下,一定量
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
| A.增大压强, |
| B.增大容器的体积,该分解反应平衡右移, |
| C.减小 |
| D.升高温度,容器内气体的压强一定变大 |
(4)以固体催化剂催化CO还原NO生成
请补充完整。
化学吸附:
表面反应:
脱附:
2022·浙江绍兴·一模
类题推荐
2020年中国向世界宣布2030年前实现碳达峰,2060年前实现碳中和。转化和吸收CO2的研究成为更加迫切的任务。
(1)在催化剂作用下CO2和H2发生反应I:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H1。已知298K时,部分物质的相对能量如表所示(忽略△H随温度的变化)。
C2H4(g)+4H2O(g) △H1。已知298K时,部分物质的相对能量如表所示(忽略△H随温度的变化)。
则△H1=_____ kJ•mol-1,该反应能够自发进行的条件是_____ (填“较高温度”或“较低温度”)。
(2)在恒温恒容条件下,向密闭容器中充入CO2、H2,加入合适催化剂,发生反应I,下列情况表明反应I达到平衡状态的是_____ (填序号)。
(3)在一体积不变的密闭容器中投入0.4molCO2和1.2molH2,发生反应I,测得CO2的平衡转化率与温度、压强的关系如图所示;
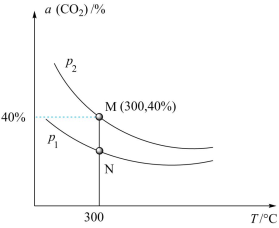
①随着温度升高,不同压强下,CO2的平衡转化率接近相等,原因是______ 。
②若反应平衡时M点(p2对应压强下)密闭容器的体积为2L,请列出计算N点条件下反应Ⅰ的平衡常数的计算式K=_____ (只列计算式)。
(4)CO2催化加H2还可能生成其他含碳化合物。研究发现,Fe、Co固体双催化剂的成分对相同时间内CO2转化率和产物选择性有重要作用,部分研究数据如表所示:
下列说法错误的是______ (填序号)。
(5)在一定条件下,选择合适的催化剂使CO2只发生转化为CO的反应:CO2(g)+H2(g) CO(g)+H2O(g) △H>0。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图所示:
CO(g)+H2O(g) △H>0。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图所示:
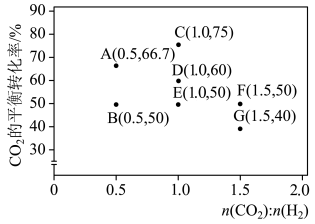
已知:Kx是以物质的量分数表示的化学平衡常数;反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。B、E、F三点反应温度最高的是_____ 点,计算E点所示的投料比在从起始到平衡的过程中,当CO2转化率达到40%时, =
=_____ 。
(1)在催化剂作用下CO2和H2发生反应I:2CO2(g)+6H2(g)
| 物质 | CO2(g) | H2O(l) | H2O(g) | H2(g) | C2H4(g) |
| 相对能量(kJ•mol-1) | -393 | -286 | -242 | 0 | 52 |
(2)在恒温恒容条件下,向密闭容器中充入CO2、H2,加入合适催化剂,发生反应I,下列情况表明反应I达到平衡状态的是
| A.C2H4的体积分数保持不变 | B.混合气体密度保持不变 |
| C.混合气体的平均摩尔质量保持不变 | D.混合气体中C2H4与H2O(g)的分压之比不变 |

①随着温度升高,不同压强下,CO2的平衡转化率接近相等,原因是
②若反应平衡时M点(p2对应压强下)密闭容器的体积为2L,请列出计算N点条件下反应Ⅰ的平衡常数的计算式K=
(4)CO2催化加H2还可能生成其他含碳化合物。研究发现,Fe、Co固体双催化剂的成分对相同时间内CO2转化率和产物选择性有重要作用,部分研究数据如表所示:
| 实验编号 | n(Fe):n(Co) | CO2转化率/% | CO选择性/% | CH4选择性/% | C2H4选择性/% | 反应后固体的成分 |
| 1 | 100∶0 | 1.1 | 100 | 0 | 0 | Fe和少量Fe3O4 |
| 2 | 50∶50 | 30.5 | 36.8 | 42.9 | 20.3 | Fe和Co |
| 3 | 0∶100 | 69.2 | 2.7 | 97.1 | 0.2 | Co |
| A.实验1中生成Fe3O4的化学方程式为3Fe+4CO2=Fe3O4+4CO |
| B.用该方法制备CH4时,最好选用金属Co作催化剂 |
| C.n(Fe):n(Co)对该制备过程影响很大 |
| D.若生成等物质的量的CH4和C2H4,转移的电子数比值为2∶1 |

已知:Kx是以物质的量分数表示的化学平衡常数;反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。B、E、F三点反应温度最高的是
“绿水青山就是金山银山”,因此研究 、
、 等大气污染物的妥善处理具有重要意义。
等大气污染物的妥善处理具有重要意义。
(1) 的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的
的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的 。已知吸收过程中相关反应的热化学方程式如下:
。已知吸收过程中相关反应的热化学方程式如下:
①
 ;
;
②
 ;
;
③
 。
。
则反应 的
的
_____ 
(2)燃煤发电厂常利用反应
 对煤进行脱硫处理来减少
对煤进行脱硫处理来减少 的排放。对于该反应,在
的排放。对于该反应,在 时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时,借助传感器测得反应在不同时间点上各物质的浓度如下:
① 内,平均反应速率
内,平均反应速率
________  ;当升高温度,该反应的平衡常数K
;当升高温度,该反应的平衡常数K________  填“增大”“减小”或“不变”
填“增大”“减小”或“不变” 。
。
② 后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是
后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是________  填字母
填字母 。
。
A.加入一定量的粉状碳酸钙
B.通入一定量的
C.适当缩小容器的体积
D.加入合适的催化剂
(3) 的排放主要来自于汽车尾气,有人利用反应
的排放主要来自于汽车尾气,有人利用反应


 ,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压,测得NO的转化率随温度的变化如图所示:
,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压,测得NO的转化率随温度的变化如图所示:
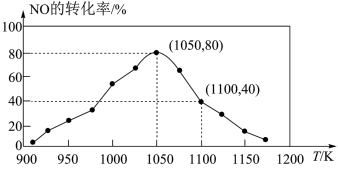
由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为________ ;在1100K时, 的体积分数为
的体积分数为________ 。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数 记作
记作 。在1050K、
。在1050K、 时,该反应的化学平衡常数
时,该反应的化学平衡常数
________  已知:气体分压
已知:气体分压 气体总压
气体总压 体积分数
体积分数 。
。
(5)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应


 ,生成无毒的
,生成无毒的 和
和 。实验测得,
。实验测得, ,
, 、
、 为速率常数,只与温度有关
为速率常数,只与温度有关 。
。
①达到平衡后,仅升高温度, 增大的倍数
增大的倍数________  填“
填“ ”“
”“ ”或“
”或“ ”
” 增大的倍数。
增大的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为 ,则
,则
__________ 。
(1)
①
②
③
则反应
(2)燃煤发电厂常利用反应
| 0 | 10 | 20 | 30 | 40 | 50 | |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①
②
A.加入一定量的粉状碳酸钙
B.通入一定量的
C.适当缩小容器的体积
D.加入合适的催化剂
(3)

由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数
(5)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应
①达到平衡后,仅升高温度,
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网

 B.
B.  C.
C.