解答题-原理综合题 适中0.65 引用2 组卷249
化学反应与能量变化
化学反应过程中,不仅有物质的变化,同时还伴随能量变化。研究化学反应中的能量变化有重要意义。
(1)下列反应中属于吸热反应的是________
(2)已知充分燃烧1 mol乙炔气体(分子式为C2H2)时生成二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是________
(3)分别取 的盐酸与
的盐酸与 的氢氧化钠溶液混合进行中和热的测定,下列说法正确的是________
的氢氧化钠溶液混合进行中和热的测定,下列说法正确的是________
(4)下列说法正确的是________
(5)如图是某化学反应中的能量变化图。
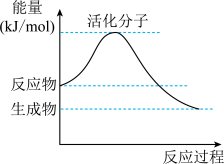
①该反应是___________ (填“吸热”或“放热”)反应。
②请在图中标注出该反应的活化能 。
。_________
(6)298K,100KPa时,把 和
和 放在某密闭容器中进行反应,热化学方程式如下:
放在某密闭容器中进行反应,热化学方程式如下:
 ,测得反应放出的热量总是少于9 kJ/mol,其原因是
,测得反应放出的热量总是少于9 kJ/mol,其原因是___________ 。
化学反应过程中,不仅有物质的变化,同时还伴随能量变化。研究化学反应中的能量变化有重要意义。
(1)下列反应中属于吸热反应的是________
| A.氢气燃烧 | B.铝粉和氧化铁粉末的反应 |
| C.浓硫酸稀释 | D.Ba(OH)2·8H2O和NH4Cl固体的反应 |
| A. |
| B. |
| C. |
| D. |

| A.仪器A是金属搅拌棒 |
| B.稍过量的氢氧化钠是确保盐酸完全反应 |
| C.酸碱混合时,NaOH溶液应缓缓倒入小烧杯中,不断搅拌 |
| D.用氢氧化钡和硫酸代替氢氧化钠和盐酸溶液,结果也是正确的 |
| A.焓变或熵变均可以单独作为反应自发性的判据 |
| B.能自发进行的反应一定能迅速发生 |
| C. |
| D.两种物质反应,无论方程式的书写形式如何, |

①该反应是
②请在图中标注出该反应的活化能
(6)298K,100KPa时,把
22-23高一下·上海浦东新·期末
类题推荐
写出或完成下列热化学方程式。
(1)下列变化过程,属于放热反应的是_______ 。
①浓 稀释;②酸碱中和反应:③
稀释;②酸碱中和反应:③ 在
在 中燃烧;④
中燃烧;④ 与
与 ;⑤铝热反应:⑧碳高温条件下还原
;⑤铝热反应:⑧碳高温条件下还原 ;⑦碳酸钙分解
;⑦碳酸钙分解
(2)已知:①

②

③

则固态碳和水蒸气反应生成CO和 的热化学方程式为
的热化学方程式为_______ 。
(3)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。表中是一些化学键的键能。
根据键能数据估算下列反应: 的反应热
的反应热 为
为_______ 。
(4)已知稀溶液中,
 。
。
①则稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出的热量比57.3kJ_______ (填“大”“小”)。若选用硫酸和氢氧化钡的稀溶液做中和热测定实验(操作无误),测定结果
_______  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②某化学兴趣小组用50mL 盐酸、50mL
盐酸、50mL  NaOH溶液进行中和热测定,计算结果
NaOH溶液进行中和热测定,计算结果 ,其原因可能是:
,其原因可能是:_______ 。
A.盐酸与NaOH溶液混合后立即记录温度
B.分三次将盐酸溶液缓慢倒入NaOH溶液中
C.用量筒量取NaOH溶液时仰视读数
D.使用环形玻璃棒搅拌
③标准状况下,3.36L 仅由C、H两种元素组成的某气体质量为4.5g,在25℃和101kPa下完全燃烧生成 和
和 时,放出233.97kJ的热量。该气体的分子式为
时,放出233.97kJ的热量。该气体的分子式为_______ ,表示该气体摩尔燃烧焓的热化学方程式为_______ 。
④2022年北京冬奥会将用绿氢( )作为火炬燃料,以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
)作为火炬燃料,以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
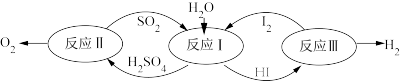
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:

则反应

_______ 。
(1)下列变化过程,属于放热反应的是
①浓
(2)已知:①
②
③
则固态碳和水蒸气反应生成CO和
(3)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。表中是一些化学键的键能。
| 化学键 | C-H | C-F | H-F | F-F |
| 键能kJ/mol | 414 | 489 | 565 | 155 |
(4)已知稀溶液中,
①则稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出的热量比57.3kJ
②某化学兴趣小组用50mL
A.盐酸与NaOH溶液混合后立即记录温度
B.分三次将盐酸溶液缓慢倒入NaOH溶液中
C.用量筒量取NaOH溶液时仰视读数
D.使用环形玻璃棒搅拌
③标准状况下,3.36L 仅由C、H两种元素组成的某气体质量为4.5g,在25℃和101kPa下完全燃烧生成
④2022年北京冬奥会将用绿氢(

反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
则反应
Ⅰ.完成下列填空。
(1)键能是指在将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:
写出1mol气态肼(H2N—NH2)燃烧生成氮气和气态水的热化学方程式___________ 。
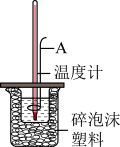
Ⅱ.用如图所示的装置测定中和反应反应热。

实验药品:100mL0.50mol/L盐酸、50mL0.55mol/LNaOH溶液、50mL0.50mol/L氨水。已知弱碱电离时吸热。回答下列问题。
(2)从实验装置上看,还缺少___________ ,其能否用铜质材料替代?___________ (填“能”或“不能”),理由是___________ 。
(3)装置中隔热层的作用是________ 。
(4)将浓度为 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为
的碱溶液各50mL混合(溶液密度均为 ),生成的溶液的比热容
),生成的溶液的比热容 ,测得温度如下:
,测得温度如下:
①两组实验结果存在差异的原因是________ 。
② 的
的 =
=________ (保留一位小数)。
③某同学利用上述装置重新做甲组实验,测得反应热 偏大,则可能的原因是
偏大,则可能的原因是______ (填序号)。
A.测完盐酸的温度直接测NaOH溶液温度 B.做该实验时室温较高
C.杯盖未盖严 D.NaOH溶液一次性迅速倒入
④若实验中若改用60mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量________ (填“相等”“不相等”),若实验操作均正确,则所求中和热________ (填“相等”“不相等”)。
(1)键能是指在将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:
| 化学键 | N≡N | O=O | N—N | N—H | O—H |
| 键能/ kJ·mol‾1 | 946 | 497 | 193 | 391 | 463 |
Ⅱ.用如图所示的装置测定中和反应反应热。

实验药品:100mL0.50mol/L盐酸、50mL0.55mol/LNaOH溶液、50mL0.50mol/L氨水。已知弱碱电离时吸热。回答下列问题。
(2)从实验装置上看,还缺少
(3)装置中隔热层的作用是
(4)将浓度为
| 反应物 | 起始温度t1/℃ | 最高温度t2/℃ |
| 甲组(HCl+NaOH) | 15.0 | 18.3 |
| 乙组(HCl+NH3∙H2O) | 15.0 | 18.1 |
②
③某同学利用上述装置重新做甲组实验,测得反应热
A.测完盐酸的温度直接测NaOH溶液温度 B.做该实验时室温较高
C.杯盖未盖严 D.NaOH溶液一次性迅速倒入
④若实验中若改用60mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量
生产生活中的化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
(1)①反应 ,生成物能量总和
,生成物能量总和_______ (填“大于”、“小于”或“等于”)反应物能量总和。
②已知:常温常压下,8g甲烷气体在足量氧气中充分燃烧生成液态水和二氧化碳气体时放出445kJ热量,写出甲烷气体的燃烧热的热化学方程式:_______ 。
(2) 焙烧产生的
焙烧产生的 可用于制硫酸。
可用于制硫酸。
已知:25℃、101kPa时, ;
;
 ;
;
 ;
;
则 与
与 反应生成
反应生成 的热化学方程式是
的热化学方程式是_______ 。
(3)某实验小组用 的NaOH溶液和
的NaOH溶液和 的
的 溶液进行中和反应的反应热测定。
溶液进行中和反应的反应热测定。
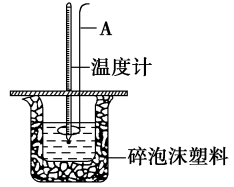
①若需配制 溶液,则需用量筒量取
溶液,则需用量筒量取_______ mL密度为 ,质量分数为98%的浓硫酸。
,质量分数为98%的浓硫酸。
②测定稀硫酸和氢氧化钠稀溶液反应的反应热的实验装置如图所示。则仪器A的名称为_______ 。
(4)取 溶液和
溶液和 溶液进行实验,实验数据如下表。
溶液进行实验,实验数据如下表。
①温度差的平均值为_______ ℃。
②近似认为 的NaOH溶液和
的NaOH溶液和 的
的 溶液的密度都是
溶液的密度都是 ,中和后生成的溶液的比热容
,中和后生成的溶液的比热容 。则测得生成
。则测得生成 时中和反应的反应热
时中和反应的反应热
_______ (取小数点后一位)。
③上述结果与理论值 有偏差,产生此偏差的原因可能是
有偏差,产生此偏差的原因可能是_______ (填标号)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.把NaOH溶液一次性倒入盛有 溶液的小烧杯中
溶液的小烧杯中
(5)碎泡沫塑料的作用是_______ 。
(1)①反应
②已知:常温常压下,8g甲烷气体在足量氧气中充分燃烧生成液态水和二氧化碳气体时放出445kJ热量,写出甲烷气体的燃烧热的热化学方程式:
(2)
已知:25℃、101kPa时,
则
(3)某实验小组用

①若需配制
②测定稀硫酸和氢氧化钠稀溶液反应的反应热的实验装置如图所示。则仪器A的名称为
(4)取
| 实验次数 | 反应物温度/℃ | 反应前体系的温度 | 反应后体系的温度 | 温度差 | |
| NaOH | |||||
| 1 | 26.6 | 26.6 | 26.6 | 29.1 | |
| 2 | 27.0 | 27.0 | 27.0 | 31.0 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①温度差的平均值为
②近似认为
③上述结果与理论值
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.把NaOH溶液一次性倒入盛有
(5)碎泡沫塑料的作用是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


