解答题-无机推断题 适中0.65 引用1 组卷193
元素周期表的表达形式有多种,但都能表示出元素的周期性变化规律,请回答下列问题:
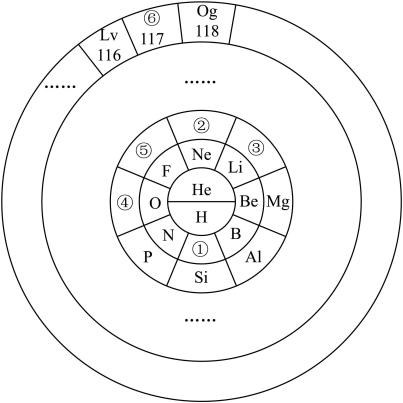
(1)①与④元素形成的化合物属于___________ 晶体。
(2)写出③的最高价氧化物对应水化物和Al的最高价氧化物的水化物相互反应的离子方程式:__________ 。
(3)②号元素为___________ (填元素符号)。请写出1个与②核外电子数相同的简单离子组成的化合物的化学式:___________ 。其中存在的化学键属于___________ 键,该物质在熔融状态下___________ 导电(填“能”或“不能”)。
(4)⑤的单质具有较强的氧化性,能与大多数金属发生反应,请写出⑤的单质与过量的铁粉反应的化学方程式:___________ ,将反应所得混合物溶于水,得到浅绿色的溶液,请写出相关的离子方程式:___________ 。
(5)其中非金属性④___________ ⑤(填“>”或“<”),请用一个化学方程式证明___________ 。
(6)⑥(原子序数117)的单质是一种具有放射性的卤族元素,它在元素周期表中的位置为___________ ,根据元素的周期性规律,以下推测正确的是________
A.单质在常温下为气体 B.气态氢化物的稳定性较好
C.离子具有强还原性 D.半径大于⑤

(1)①与④元素形成的化合物属于
(2)写出③的最高价氧化物对应水化物和Al的最高价氧化物的水化物相互反应的离子方程式:
(3)②号元素为
(4)⑤的单质具有较强的氧化性,能与大多数金属发生反应,请写出⑤的单质与过量的铁粉反应的化学方程式:
(5)其中非金属性④
(6)⑥(原子序数117)的单质是一种具有放射性的卤族元素,它在元素周期表中的位置为
A.单质在常温下为气体 B.气态氢化物的稳定性较好
C.离子具有强还原性 D.半径大于⑤
22-23高一下·上海黄浦·期末
类题推荐
已知:A、B、C、D是短周期主族元素,E、F为长周期元素,请根据下列信息回答有关问题。
(1)写出A元素的最高价氧化物的电子式:___________ ;C、D、E的简单离子半径由大到小的顺序为___________ (填离子符号)。
(2)写出E元素的氧化物( )与水反应的离子方程式:
)与水反应的离子方程式:___________ 。
(3)F元素的单质可以在C元素的单质中燃烧,其产物的饱和溶液与沸水反应可以得到能产生丁达尔效应的分散系,写出该产物的浓溶液与沸水反应的化学方程式:___________ 。
(4)C元素的最高价氧化物对应的水化物与E元素的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(5)B元素与E元素形成的化合物属于___________ (填“离子”或“共价”)化合物,该化合物中所含的化学键为___________ (填“共价键”或“离子键”)。
| ① | A的一种氧化物可用于人工降雨 |
| ② | B元素的简单阳离子中没有电子 |
| ③ | C的单质为黄绿色气体 |
| ④ | D是地壳中含量最高的金属元素 |
| ⑤ | E位于元素周期表第ⅠA族,核外电子层数为4 |
| ⑥ | F是用途最广泛的金属,它的一种氧化物可以作磁性材料 |
(2)写出E元素的氧化物(
(3)F元素的单质可以在C元素的单质中燃烧,其产物的饱和溶液与沸水反应可以得到能产生丁达尔效应的分散系,写出该产物的浓溶液与沸水反应的化学方程式:
(4)C元素的最高价氧化物对应的水化物与E元素的最高价氧化物对应的水化物反应的离子方程式为
(5)B元素与E元素形成的化合物属于
如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:
(1)③、④、⑦的原子半径由大到小的顺序是___________ (用元素符号表示)。
(2)下列事实能说明②元素的非金属性比⑥元素的非金属性强的是_______ 。
A.②的单质与⑥元素的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1 mol②单质比l mol⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式____________________ 。
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式_____________ 。
(5)已知W+X=Y+Z(反应需要加热),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),写出该化学方程式______________ 。
(6)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
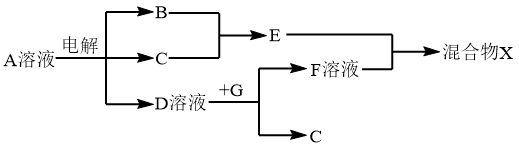
①写出D溶液与G反应的离子方程式_______________ 。
②写出检验A溶液中溶质的阴离子的方法_______________ 。
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ⑧ | ⑨ | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(2)下列事实能说明②元素的非金属性比⑥元素的非金属性强的是
A.②的单质与⑥元素的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1 mol②单质比l mol⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式
(5)已知W+X=Y+Z(反应需要加热),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),写出该化学方程式
(6)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。

①写出D溶液与G反应的离子方程式
②写出检验A溶液中溶质的阴离子的方法
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


