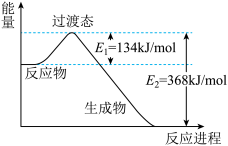
填空题 适中0.65 引用2 组卷448
将氧化铁还原为铁的技术在人类文明的进步中占有十分重要的地位。炼铁高炉中发生的关键反应如下:
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
CO2(g)+C(s)=2CO(g) ΔH=+172.46 kJ/mol
Fe2O3+CO→Fe+CO2
若已知:2Fe(s)+ O2(g)=Fe2O3(s) ΔH=-824.21 kJ/mol
O2(g)=Fe2O3(s) ΔH=-824.21 kJ/mol
根据上面三个热化学方程式,回答下列问题:
(1)CO的摩尔燃烧焓为_______ ;写出其热化学方程式:_______ 。
(2)高炉内Fe2O3被CO还原为Fe的热化学方程式为_______ 。
(3)炼制1吨含铁96%的生铁所需焦炭的理论用量是_______ 吨,实际生产中所需焦炭远高于理论用量,其原因是_______ 。
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
CO2(g)+C(s)=2CO(g) ΔH=+172.46 kJ/mol
Fe2O3+CO→Fe+CO2
若已知:2Fe(s)+
根据上面三个热化学方程式,回答下列问题:
(1)CO的摩尔燃烧焓为
(2)高炉内Fe2O3被CO还原为Fe的热化学方程式为
(3)炼制1吨含铁96%的生铁所需焦炭的理论用量是
23-24高二上·全国·课时练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网