解答题-原理综合题 较难0.4 引用1 组卷426
油气开采、石油化工、煤化工等行业产生的废气普遍含有硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
①
②
则反应③ 的
的
_________________  ;下列叙述能说明反应③达到平衡状态的是
;下列叙述能说明反应③达到平衡状态的是_________________ (填标号)。
a.断裂 的同时生成
的同时生成
B.恒温恒压条件下,混合气体的平均摩尔质量不再变化
C.恒温恒容条件下,混合气体的密度不再变化
D.
(2)对于上述反应①,在不同温度、压强为 、进料
、进料 的物质的量分数为
的物质的量分数为 (其余为
(其余为 )的条件下,
)的条件下, 的平衡转化率如图1所示。
的平衡转化率如图1所示。 和
和 的大小关系为
的大小关系为_________________ 。
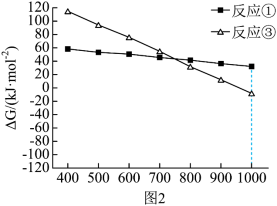
(3)上述反应①和③的 随温度的变化如图2所示,已知
随温度的变化如图2所示,已知 (
( 为常数,
为常数, 为温度,
为温度, 为平衡常数),则在
为平衡常数),则在 时,反应的自发趋势:①
时,反应的自发趋势:①_________________ ③(选填“>”“<”或“=”)。在 、
、 条件下,
条件下, 的混合气发生反应,达到平衡时
的混合气发生反应,达到平衡时 接近于0,其原因是
接近于0,其原因是__________________________________ 。
(4)在恒温恒压 条件下,
条件下, 的混合气仅发生反应③,达到平衡时,
的混合气仅发生反应③,达到平衡时, 的分压与
的分压与 的分压相同。则
的分压相同。则 的转化率为
的转化率为_________________ ,反应③的
_________________ 。
(1)已知下列反应的热化学方程式:
①
②
则反应③
a.断裂
B.恒温恒压条件下,混合气体的平均摩尔质量不再变化
C.恒温恒容条件下,混合气体的密度不再变化
D.
(2)对于上述反应①,在不同温度、压强为

(3)上述反应①和③的
(4)在恒温恒压
22-23高二下·湖南长沙·期末
类题推荐
天然气开采产生的废气普遍含有硫化氢,需要回收处理并加以利用。
回答下列问题:
(1)已知下列反应的热化学方程式:
① ;
;
②
则反应③
___________ 。
(2)下列叙述不能说明反应③达到平衡状态的有___________(填标号)。
(3)在恒压条件下,按投料比 分别为
分别为 进行反应③,该反应中
进行反应③,该反应中 的平衡转化率随温度变化如图所示,则曲线a对应的投料比为
的平衡转化率随温度变化如图所示,则曲线a对应的投料比为___________ ; 的平衡转化率随温度降低而减小的原因是
的平衡转化率随温度降低而减小的原因是_________________________________ 。
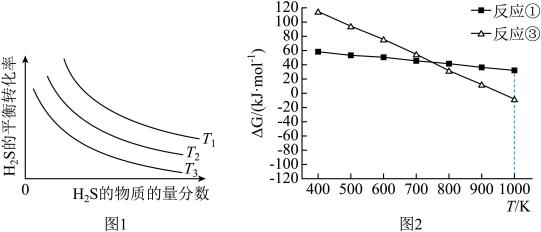
(4)在恒温( )、恒压(
)、恒压( )反应条件下,将
)反应条件下,将 的混合气进行反应③,达到平衡时,
的混合气进行反应③,达到平衡时, 的分压与
的分压与 的分压相同。则该反应的
的分压相同。则该反应的
___________  (
( 是以分压表示的平衡常数,分压=总压×物质的量分数)
是以分压表示的平衡常数,分压=总压×物质的量分数)
(5)天然气开采产生的硫化氢也可通过如图所示的电化学装置进行处理。
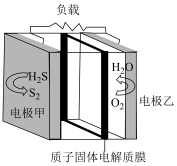
①电极甲为电池的________ (填“负极”或“正极”),该电极的电极反应式为______________________ 。
②电池工作时, 的移动方向是
的移动方向是______________________ 。(填“从左到右”或“从右到左”)
回答下列问题:
(1)已知下列反应的热化学方程式:
①
②
则反应③
(2)下列叙述不能说明反应③达到平衡状态的有___________(填标号)。
| A.形成 |
| B.恒温恒容条件下,体系压强不再变化 |
| C.恒温恒容条件下,气体的密度不再变化 |
| D.混合气体的平均摩尔质量不再变化 |
(3)在恒压条件下,按投料比

(4)在恒温(
(5)天然气开采产生的硫化氢也可通过如图所示的电化学装置进行处理。

①电极甲为电池的
②电池工作时,
油气开采、石油化工、煤化工等行业的废气中普遍含有 ,需要对
,需要对 回收处理并加以利用。
回收处理并加以利用。
已知:①
②
③
回答下列问题:
(1)反应③的
___________ 。
(2)下列叙述不能说明反应③达到平衡状态的是___________(填标号)。
(3)在不同温度、反应压强为 ,进料
,进料 的物质的量分数为
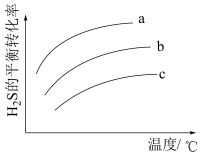
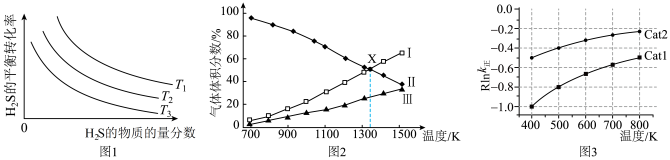
的物质的量分数为 的条件下(其余为N2),对于反应①来说,H2S分解的平衡转化率与H2S的物质的量分数的关系如图1所示。则温度T1、T2、T3由大到小的顺序为
的条件下(其余为N2),对于反应①来说,H2S分解的平衡转化率与H2S的物质的量分数的关系如图1所示。则温度T1、T2、T3由大到小的顺序为___________ 。温度一定时,H2S的物质的量分数越大,H2S分解的平衡转化率越小,原因是___________ 。 时,向恒压密闭容器中充入
时,向恒压密闭容器中充入 发生反应①,平衡时各组分的体积分数与温度的关系如图2所示。代表
发生反应①,平衡时各组分的体积分数与温度的关系如图2所示。代表 的是曲线
的是曲线___________ (填“I”“II”或“III”)。X点对应温度下,反应①的压强平衡常数
___________  。
。
(5)反应①的速率方程为 ,
, 为速率常数)。
为速率常数)。
①某温度下,反应①的化学平衡常数K=10,k逆=3,则k正=___________ 。
②已知: (式中,R为常数,
(式中,R为常数, 单位为
单位为 ,温度
,温度 单位为K,E正表示正反应的活化能,单位为kJ·mol-1)。Rlink正与不同催化剂(Catl、Cat2为催化剂)、温度(
单位为K,E正表示正反应的活化能,单位为kJ·mol-1)。Rlink正与不同催化剂(Catl、Cat2为催化剂)、温度( )关系如图3所示。相同条件下,催化效率较高的是
)关系如图3所示。相同条件下,催化效率较高的是___________ (填“Catl”或“Cat2”),判断依据是___________ 。在催化剂Cat2作用下,正反应的活化能为___________  。
。
已知:①
②
③
回答下列问题:
(1)反应③的
(2)下列叙述不能说明反应③达到平衡状态的是___________(填标号)。
| A.断裂 |
| B.恒容恒温条件下,反应体系的气体压强不再变化 |
| C.恒容条件下,反应体系的气体密度不再变化 |
| D.反应速率: |
(3)在不同温度、反应压强为
(5)反应①的速率方程为
①某温度下,反应①的化学平衡常数K=10,k逆=3,则k正=
②已知:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网