解答题-实验探究题 适中0.65 引用2 组卷205
某小组同学实验验证“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
(1)实验验证
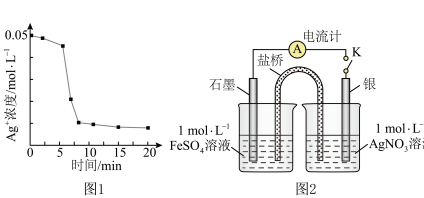
实验I:将0.0100mol/LAg2SO4溶液与0.0400mo/LFeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验Ⅱ:向少量Ag粉中加入0.0100mol/LFe2(SO4)3溶液(pH=1),固体完全溶解。
①取I中沉淀,加入浓硝酸,证实灰黑色沉淀为Ag。请写出该反应的离子方程式:_______ 。
②Ⅱ中溶液选用Fe2(SO4)3,不选用Fe(NO3)3的原因为_______ 。
综合上述实验,证实“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
(2)采用电化学装置进行验证。
小组同学设计如上图电化学装置进行实验:
i.按照上图的装置图,组装好仪器后,分别在两烧杯中加入一定浓度的a、b两电解质溶液,闭合开关K,观察到的现象为:Ag电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应达到平衡。则a为_______ 溶液;b为_______ 溶液;(写a、b化学式)
ii.再向左侧烧杯中滴加较浓的_______ 溶液,产生的现象为_______ 。表明“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
(1)实验验证
实验I:将0.0100mol/LAg2SO4溶液与0.0400mo/LFeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验Ⅱ:向少量Ag粉中加入0.0100mol/LFe2(SO4)3溶液(pH=1),固体完全溶解。
①取I中沉淀,加入浓硝酸,证实灰黑色沉淀为Ag。请写出该反应的离子方程式:
②Ⅱ中溶液选用Fe2(SO4)3,不选用Fe(NO3)3的原因为
综合上述实验,证实“Ag++Fe2+
(2)采用电化学装置进行验证。

小组同学设计如上图电化学装置进行实验:
i.按照上图的装置图,组装好仪器后,分别在两烧杯中加入一定浓度的a、b两电解质溶液,闭合开关K,观察到的现象为:Ag电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应达到平衡。则a为
ii.再向左侧烧杯中滴加较浓的
22-23高二上·福建福州·期中
类题推荐
Ⅰ.某小组同学采用电化学装置验证“ ”为可逆反应。
”为可逆反应。
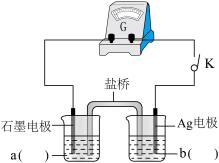
(1)按照如图的装置图,组装好仪器后,分别在两烧杯中加入一定浓度的a、b两电解质溶液,闭合开关K,观察到的现象为:Ag电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应达到平衡。则a为___________ 溶液;b为___________ 溶液;(写a、b化学式)
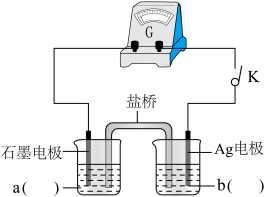
(2)再向左侧烧杯中滴加较浓的___________ 溶液,产生的现象为___________ 。表明“ ”为可逆反应。
”为可逆反应。
Ⅱ.利用电极反应可探究物质氧化性、还原性的变化规律。
已知:酸性介质中,1mol/L不同电对的电极电势见下表。电极电势越高,其氧化型物质的氧化性越强;电极电势越低,其还原型物质的还原性越强。
用可逆反应 设计电池,按图a装置进行实验,测得电压
设计电池,按图a装置进行实验,测得电压 随时间t的变化如图b所示:
随时间t的变化如图b所示:
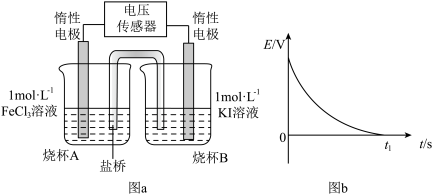
(3)电池初始工作时,正极的电极反应式为___________ 。
(4)某小组从还原型物质浓度、氧化性变化的角度分析图b,提出以下猜想:
猜想1: 增大,
增大, 的氧化性减弱,正极的电极电势降低。
的氧化性减弱,正极的电极电势降低。
猜想2: 减小,
减小, 的氧化性增强,负极的电极电势升高。
的氧化性增强,负极的电极电势升高。
① 时间后,按图a装置探究,验证上述猜想的合理性,完成表中填空。
时间后,按图a装置探究,验证上述猜想的合理性,完成表中填空。
②有同学认为,上述实验不足以证明猜想1成立。利用上述反应,从化学平衡移动的角度解释猜想1不足以成立的理由___________ 。
③为进一步验证猜想1,进行实验ⅲ,完成表中填空。
结论:可逆氧化还原反应中,浓度的变化引起电对氧化性变化,从而改变电池反应方向。
(1)按照如图的装置图,组装好仪器后,分别在两烧杯中加入一定浓度的a、b两电解质溶液,闭合开关K,观察到的现象为:Ag电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应达到平衡。则a为

(2)再向左侧烧杯中滴加较浓的
Ⅱ.利用电极反应可探究物质氧化性、还原性的变化规律。
已知:酸性介质中,1mol/L不同电对的电极电势见下表。电极电势越高,其氧化型物质的氧化性越强;电极电势越低,其还原型物质的还原性越强。
| 电对(氧化型/还原型) | ||
| 电极电势 | 0.771 | 0.536 |

(3)电池初始工作时,正极的电极反应式为
(4)某小组从还原型物质浓度、氧化性变化的角度分析图b,提出以下猜想:
猜想1:
猜想2:
①
| 实验 | 实验操作 | 电压E/V | 结论 |
| ⅰ | 往烧杯A中加入适量Fe | E | 猜想1成立 |
| ⅱ | 往烧杯B中加入适量 | 猜想2成立 |
③为进一步验证猜想1,进行实验ⅲ,完成表中填空。
| 实验 | 实验操作 | 电压E/V | 结论 |
| ⅲ | 往烧杯A中加入适量 | 猜想1成立 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网