解答题-原理综合题 较难0.4 引用1 组卷336
Ⅰ.利用
反应①
反应②
有关物质的相对能量与反应历程的变化如图a所示[
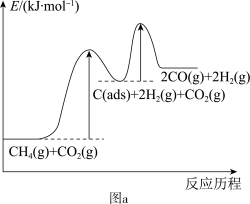
(1)总反应
(2)研究表明,总反应速率由反应①决定,请结合图a与碰撞理论说明原因:
Ⅱ.工业上可利用
反应③
反应④
在
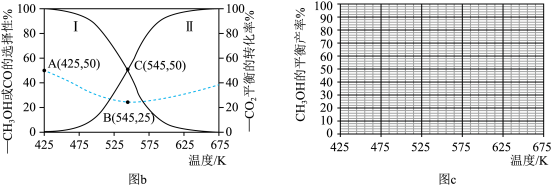
(3)研究表明,原料气中掺入适量
(4)下列说法正确的是_______。
| A.曲线Ⅰ代表 |
| B.温度越低,越有利于工业生产 |
| C.上述反应条件下, |
| D.其他条件不变,增大压强能同时提高 |
(6)
2022·浙江·二模
类题推荐
化学固定、催化活化循环利用 的研究,备受重视。铜基催化剂上
的研究,备受重视。铜基催化剂上 加氢合成甲醇是重要的利用途径。该工艺主要发生合成甲醇的反应I和逆水汽变换反应Ⅱ。
加氢合成甲醇是重要的利用途径。该工艺主要发生合成甲醇的反应I和逆水汽变换反应Ⅱ。
I.
 ,
,
Ⅱ.
 ,
,
Ⅲ:

已知甲醇的选择性
请回答:
(1)
_______ ,反应Ⅲ自发进行的条件是_______ 。
(2)恒温恒容条件下,原料气 (g)、
(g)、 (g)以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为50%。已知初始
(g)以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为50%。已知初始 ,
, 平衡转化率为50%,则该条件下
平衡转化率为50%,则该条件下
_______ 。
(3)以50Cu/45Zn/5Al为催化剂,催化剂表面金属能吸附 、CO、
、CO、 分子,反应I和Ⅱ发生在催化剂表面的不同活性位点。在240℃、2MPa条件下,将原料气按照a、b、c、d四种方式以相同流速通过催化剂,测得各组分转化率(X)和选择性(S)如表1所示。另测得
分子,反应I和Ⅱ发生在催化剂表面的不同活性位点。在240℃、2MPa条件下,将原料气按照a、b、c、d四种方式以相同流速通过催化剂,测得各组分转化率(X)和选择性(S)如表1所示。另测得 转化率、甲醇选择性与温度、原料气组成关系如图8、图9所示。
转化率、甲醇选择性与温度、原料气组成关系如图8、图9所示。
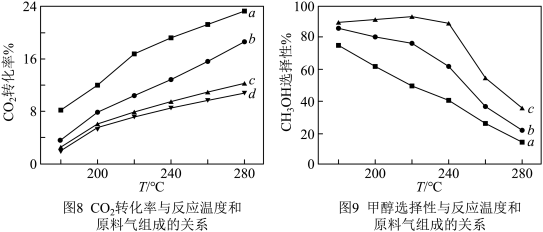
表1 催化剂性能与原料气组成的关系
①分析表1数据,推测随着原料气中掺杂CO体积分数的增大, 转化率迅速降低、甲醇选择性急剧增大的原因
转化率迅速降低、甲醇选择性急剧增大的原因_______ 。
②结合表1、图8、图9等有关知识,下列说法正确的是_______ 。
A.其他条件一定时,原料气中CO体积分数越大,生成甲醇越多
B.一定范围内升高温度利于 与催化剂活性位点结合,可以提高
与催化剂活性位点结合,可以提高 的转化率
的转化率
C.根据图9中的a线,推测温度对反应Ⅱ的速率影响比反应I大
D.增大流速,原料气与催化剂碰撞的机会多,甲醇产率一定增加
③请在图9中画出按照d投料时甲醇的选择性随温度变化的曲线_______ 。
I.
Ⅱ.
Ⅲ:
已知甲醇的选择性
请回答:
(1)
(2)恒温恒容条件下,原料气
(3)以50Cu/45Zn/5Al为催化剂,催化剂表面金属能吸附

表1 催化剂性能与原料气组成的关系
| 原料气(体积分数) | ||||
| (a)16:0:84 | 18 | 0 | 43 | 56 |
| (b)16:0.6:83.4 | 12 | 0 | 61 | 38 |
| (c)16:2:82 | 11 | 0 | 89 | 11 |
| (d)16:4:80 | 9 | 6.0 | 99 | 0 |
②结合表1、图8、图9等有关知识,下列说法正确的是
A.其他条件一定时,原料气中CO体积分数越大,生成甲醇越多
B.一定范围内升高温度利于
C.根据图9中的a线,推测温度对反应Ⅱ的速率影响比反应I大
D.增大流速,原料气与催化剂碰撞的机会多,甲醇产率一定增加
③请在图9中画出按照d投料时甲醇的选择性随温度变化的曲线
我国明确提出2060年“碳中和”目标,意味着需要通过工艺改造、节能等措施减少在能源的产生、转换、消费过程中二氧化碳的排放。回答下列问题:
Ⅰ.利用CO2和CH4制备合成气(CO、H2),该反应分两步进行。
反应①:CH4(g) C(s)+2H2(g)
C(s)+2H2(g)
反应②:C(s)+CO2(g) 2CO(g)
2CO(g)
上述反应中C(s)为吸附性活性炭,有关物质的相对能量与反应历程的变化如图所示。 2H2(g)+2CO(g)能自发进行的条件为
2H2(g)+2CO(g)能自发进行的条件为___________ ;研究表明,总反应速率由反应①决定,请结合图1与碰撞理论说明原因:___________ 。
Ⅱ.将CO2催化还原,是目前处理CO2的重要方法。
ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1<0
CH3OH(g)+H2O(g) ΔH1<0
ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
(2)已知CO和H2的燃烧热分别为-283 kJ/mol和-285.8 kJ/mol, H2O(l)=H2O(g) ΔH3=+44 kJ/mol,则ΔH2=___________ kJ/mol。
(3)恒温恒容的密闭容器中,投入物质的量之比为1∶3的CO2和H2,发生反应ⅰ达到平衡。下列有关叙述正确的是___________(填字母)。
(4)在一定条件下,向1 L恒容密闭容器中充入2 mol CO2和6 mol H2,发生反应ⅰ,测得在相同时间内,不同温度下H2的转化率如图所示,计算T2时反应ⅰ的平衡K=___________ (结果保留一位小数)。
Ⅰ.利用CO2和CH4制备合成气(CO、H2),该反应分两步进行。
反应①:CH4(g)
反应②:C(s)+CO2(g)
上述反应中C(s)为吸附性活性炭,有关物质的相对能量与反应历程的变化如图所示。

Ⅱ.将CO2催化还原,是目前处理CO2的重要方法。
ⅰ.CO2(g)+3H2(g)
ⅱ.CO2(g)+H2(g)
(2)已知CO和H2的燃烧热分别为-283 kJ/mol和-285.8 kJ/mol, H2O(l)=H2O(g) ΔH3=+44 kJ/mol,则ΔH2=
(3)恒温恒容的密闭容器中,投入物质的量之比为1∶3的CO2和H2,发生反应ⅰ达到平衡。下列有关叙述正确的是___________(填字母)。
| A.升高温度,逆反应速率增加,平衡常数减小 |
| B.按相同比例再加入一定量的CO2和H2,CO2和H2的转化率同时增大 |
| C.加入合适的催化剂可提高CO2的平衡转化率 |
| D.其他条件不变,改为恒温恒压,可以提高平衡时CH3OH的百分含量 |
(4)在一定条件下,向1 L恒容密闭容器中充入2 mol CO2和6 mol H2,发生反应ⅰ,测得在相同时间内,不同温度下H2的转化率如图所示,计算T2时反应ⅰ的平衡K=

甲醇是一种可再生能源,用 和
和 合成甲醇的过程主要有以下反应:
合成甲醇的过程主要有以下反应:
反应I:

反应II:

反应III:

请回答:
(1)反应III自发进行的条件是___________ 。
(2)恒温恒容条件下,若仅发生反应II,反应达到平衡的标志是___________。
(3)在5.0MPa恒定压强和催化剂作用下,以 的投入量进行反应,体系到达平衡后的CO与
的投入量进行反应,体系到达平衡后的CO与 在含碳产物中的物质的量百分数、
在含碳产物中的物质的量百分数、 转化率随温度的变化如图1所示。
转化率随温度的变化如图1所示。 在含碳产物中物质的量百分数的曲线是
在含碳产物中物质的量百分数的曲线是___________ (填a或b)。
② 平衡转化率随温度的升高先减小后增大,增大的原因可能是
平衡转化率随温度的升高先减小后增大,增大的原因可能是___________ 。
(4)反应I、III的逆过程又称为甲醇水蒸气重整,是电动汽车常见的氢源。在常压、CaO催化下, 和
和 以体积比1:1.2混合,总物质的量为2.2mol,反应至
以体积比1:1.2混合,总物质的量为2.2mol,反应至 时刻测得
时刻测得 转化率及CO、
转化率及CO、 选择性随温度变化分别如图2所示,260℃时
选择性随温度变化分别如图2所示,260℃时 的物质的量随时间的变化曲线如图3所示。
的物质的量随时间的变化曲线如图3所示。___________ 。
A.反应适宜温度为300℃
B.工业生产通常在高压条件下进行甲醇水蒸气重整
C.CaO催化剂具有更高催化活性,可以提高甲醇平衡转化率
D.其他条件不变,适当升高温度有利于提高 的产率
的产率
②通过计算在图3中画出300℃时,反应至 时刻
时刻 物质的量随时间变化的曲线。
物质的量随时间变化的曲线。___________
反应I:
反应II:
反应III:
请回答:
(1)反应III自发进行的条件是
(2)恒温恒容条件下,若仅发生反应II,反应达到平衡的标志是___________。
| A.CO的分压不再发生变化 | B.气体平均相对分子质量不再发生变化 |
| C.气体密度不再发生变化 | D. |
(3)在5.0MPa恒定压强和催化剂作用下,以
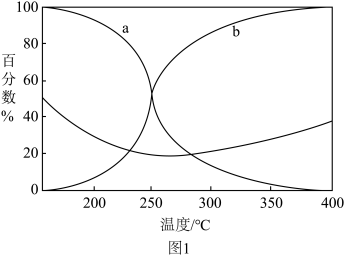
②
(4)反应I、III的逆过程又称为甲醇水蒸气重整,是电动汽车常见的氢源。在常压、CaO催化下,
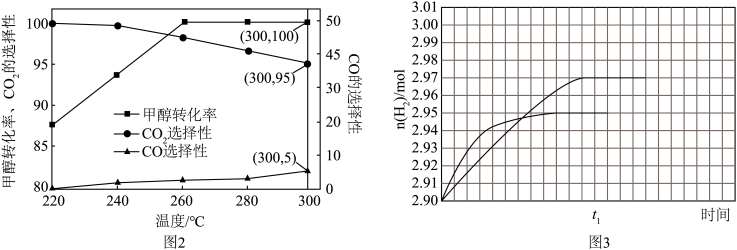
A.反应适宜温度为300℃
B.工业生产通常在高压条件下进行甲醇水蒸气重整
C.CaO催化剂具有更高催化活性,可以提高甲醇平衡转化率
D.其他条件不变,适当升高温度有利于提高
②通过计算在图3中画出300℃时,反应至
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


