解答题-原理综合题 较难0.4 引用1 组卷204
以 为代表的温室气体大量排放易导致极端天气的出现,减少碳排放,推进碳中和,提升
为代表的温室气体大量排放易导致极端天气的出现,减少碳排放,推进碳中和,提升 的综合利用技术,降低空气中
的综合利用技术,降低空气中 的含量显得刻不容缓。目前
的含量显得刻不容缓。目前 的综合利用技术常用的有如下三种:
的综合利用技术常用的有如下三种:
一、光催化技术
(1)中国广州分析测试中心研究团队在温和条件下用 合成
合成 ,方程式为:
,方程式为:

已知生成乙醛的净反应速率为 (
( 、
、 分别表示正、逆反应速率常数)。若在某一温度下
分别表示正、逆反应速率常数)。若在某一温度下 ,则此温度下,上述反应的平衡常数
,则此温度下,上述反应的平衡常数
__________ 。
二、电化学技术
(2)研究证明 也可在熔融碳酸钠中通过电解生成
也可在熔融碳酸钠中通过电解生成 ,收集
,收集 可进行其他有机类合成,化废为宝。则生成
可进行其他有机类合成,化废为宝。则生成 的电极反应式是
的电极反应式是____________________ 。
三、化学催化技术
恒温、体积不变的密闭容器中,加入一定量的 和
和 ,在催化剂下同时发生反应Ⅰ、Ⅱ。
,在催化剂下同时发生反应Ⅰ、Ⅱ。
反应Ⅰ

反应Ⅱ

回答下列问题:
(3)下列说法不正确 的是__________。
(4)其他条件相同,仅改变容器体积,实验测得 的平衡产率随着压强的增加而减少,可能原因是
的平衡产率随着压强的增加而减少,可能原因是________________ 。
(5)在一定条件下,选择合适的催化剂只进行反应Ⅱ,调整 和
和 初始投料比,测得在一定投料比和一定温度下,
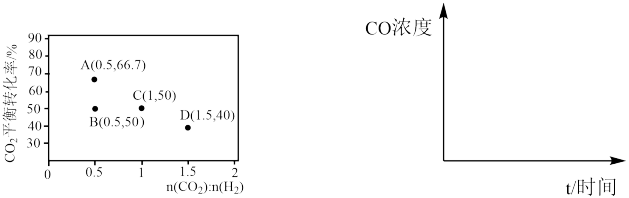
初始投料比,测得在一定投料比和一定温度下, 的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。
的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。
①C、D二点对应的反应温度 、
、 的关系是
的关系是__________ 。
②A、B两点的起始浓度相同,请分别在如图定性画出CO浓度随时间的变化关系,请在曲线上标明 和
和
_______ 。
一、光催化技术
(1)中国广州分析测试中心研究团队在温和条件下用
已知生成乙醛的净反应速率为
二、电化学技术
(2)研究证明
三、化学催化技术
恒温、体积不变的密闭容器中,加入一定量的
反应Ⅰ
反应Ⅱ
回答下列问题:
(3)下列说法
| A.反应Ⅰ的活化能 | B.容器内压强不变时可以判断反应达到平衡 |
| C.该温度下,反应Ⅱ的 | D.使用性能更佳的催化剂可以提高 |
(5)在一定条件下,选择合适的催化剂只进行反应Ⅱ,调整
①C、D二点对应的反应温度
②A、B两点的起始浓度相同,请分别在如图定性画出CO浓度随时间的变化关系,请在曲线上标明

22-23高二下·浙江·阶段练习
类题推荐
我国明确提出2030年“碳达峰”与2060年“碳中和”目标,“碳中和”对我国意味着:一是能源转型首当其冲:二是通过工艺改造、节能等措施减少二氧化碳的排放在能源的产生、转换、消费过程。
I.减少二氧化碳排放的方法之一是将CO2催化还原,比如:
反应1:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-53.7kJ•mol-1
CH3OH(g)+H2O(g) △H1=-53.7kJ•mol-1
反应2:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
都是目前处理CO2的重要方法。回答下列问题:
(1)反应1在_____ 的条件下能自发发生,该反应的活化能Ea(正)_____ Ea(逆)(填“大于”或“小于”)。
(2)已知:①CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1
②H2O(l)=H2O(g) △H3=44.0kJ•mol-1,则△H2=_____ kJ•mol-1。
(3)恒温恒容的密闭容器中,投入物质的量之比为1∶3的CO2和H2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-53.7kJ•mol-1达到平衡,下列有关叙述正确的是
CH3OH(g)+H2O(g) △H1=-53.7kJ•mol-1达到平衡,下列有关叙述正确的是_____ 。
(4)一定条件下,在1L密闭容器中加入2molCO2和2molH2只发生反应2:CO2(g)+H2(g) CO(g)+H2O(g),如图是随着反应的进行,CO2的浓度随时间改变的变化图。若在t1时刻再加入1molCO2,t2时刻到达新的平衡。请你画出t1~t3内时刻CO2的物质的量浓度随时间改变的变化图
CO(g)+H2O(g),如图是随着反应的进行,CO2的浓度随时间改变的变化图。若在t1时刻再加入1molCO2,t2时刻到达新的平衡。请你画出t1~t3内时刻CO2的物质的量浓度随时间改变的变化图_____ 。

(5)II.减少二氧化碳排放的方法之二是使用合适催化剂可由CO2和CH4可转化为CH3COOH,但反应中催化剂活性会因积碳反应CH4(g)=C(s)+2H2(g)而降低,同时存在的消碳反应CO2(s)+C(s)=2CO(g)则使积碳量减少。在一定温度下,测得某催化剂上沉积碳的生成速率方程:v=k•p(CH4)•[p(CO2)]-0.5 (k为速率常数)。在p(CH4)一定时,pa(CO2)>pb(CO2)>pc(CO2),如图可以表示不同p(CO2)下积碳量随时间的变化趋势的是_____ (填序号)。
(6)III.减少二氧化碳排放的方法之三是使用电化学方法转化CO2,研究证明:CO2也可在熔融碳酸钠中通过电解生成CO,收集CO进行其他有机类合成。则生成CO的反应发生在_____ 极,该电极反应式是____ 。
I.减少二氧化碳排放的方法之一是将CO2催化还原,比如:
反应1:CO2(g)+3H2(g)
反应2:CO2(g)+H2(g)
都是目前处理CO2的重要方法。回答下列问题:
(1)反应1在
(2)已知:①CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1
②H2O(l)=H2O(g) △H3=44.0kJ•mol-1,则△H2=
(3)恒温恒容的密闭容器中,投入物质的量之比为1∶3的CO2和H2,发生反应:CO2(g)+3H2(g)
| A.升高温度,逆反应速率增加,平衡常数减小 |
| B.再加入一定量的CO2和H2,CO2和H2的转化率不可能同时都增大 |
| C.加入合适的催化剂可以提高CO2的平衡转化率 |
| D.其他条件不变,改为恒温恒压,可以提高平衡时CH3OH的百分含量 |

(5)II.减少二氧化碳排放的方法之二是使用合适催化剂可由CO2和CH4可转化为CH3COOH,但反应中催化剂活性会因积碳反应CH4(g)=C(s)+2H2(g)而降低,同时存在的消碳反应CO2(s)+C(s)=2CO(g)则使积碳量减少。在一定温度下,测得某催化剂上沉积碳的生成速率方程:v=k•p(CH4)•[p(CO2)]-0.5 (k为速率常数)。在p(CH4)一定时,pa(CO2)>pb(CO2)>pc(CO2),如图可以表示不同p(CO2)下积碳量随时间的变化趋势的是
A.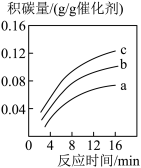 | B.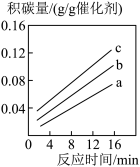 |
C.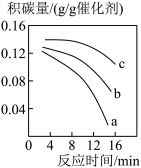 | D. |
我国将在2023年前实现碳达峰、2060年前实现碳中和。“碳中和”是指 CO2的排放总量和减少总量相当。CO2的资源化利用能有效减少CO2排放。
Ⅰ.研究表明CO2与CH4在催化剂存在下可发生反应制得合成气:CO2(g)+ CH4(g) 2CO(g)+2H2 (g)
2CO(g)+2H2 (g)  >0
>0
(1)此反应的活化能Ea(正)___________ Ea(逆)(填“>”、“=”或“<”)。
(2)某温度下,向一恒容密闭容器中充入CO2和CH4发生上述反应,初始时CO2和CH4的分压分别为15kPa、20kPa,一段时间达到平衡后,测得体系压强增加了10kPa,则该反应的平衡常数Kp=___________ (kPa)2(结果保留两位有效数字,用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。
Ⅱ.CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应①:CO2(g)+H2(g)CO(g)+H2O(g) = +41.2kJ·mol-1
= +41.2kJ·mol-1
反应②:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)
在恒压,CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:CH3OCH3的选择性= 。
。 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)  =-204.9kJ·mol-1则反应②的
=-204.9kJ·mol-1则反应②的 =
= ___________  。
。
(4)温度高于300℃,CO2平衡转化率随温度升高而上升的原因是___________ 。
(5)220℃时,在催化剂作用下CO2与H2反应一段时间 后,测得CH3OCH3的选择性对应图中A点数据。下列说法正确的是___________。
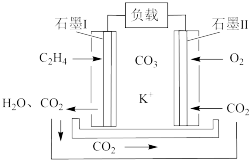
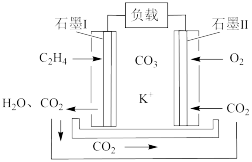
(6)某乙烯熔融碳酸盐燃料电池工作原理如图所示,则负极上电极反应式为___________ 。若要维持电池持续稳定工作,则从理论上讲,进入石墨Ⅱ电极上的CO2与石墨Ⅰ电极上生成的CO2的物质的量之比是___________ 。
Ⅰ.研究表明CO2与CH4在催化剂存在下可发生反应制得合成气:CO2(g)+ CH4(g)
(1)此反应的活化能Ea(正)
(2)某温度下,向一恒容密闭容器中充入CO2和CH4发生上述反应,初始时CO2和CH4的分压分别为15kPa、20kPa,一段时间达到平衡后,测得体系压强增加了10kPa,则该反应的平衡常数Kp=
Ⅱ.CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应①:CO2(g)+H2(g)CO(g)+H2O(g)
反应②:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)
在恒压,CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:CH3OCH3的选择性=
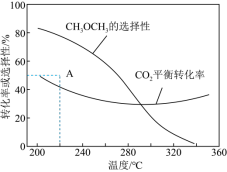
(4)温度高于300℃,CO2平衡转化率随温度升高而上升的原因是
(5)220℃时,在催化剂作用下CO2与H2反应
| A.其他反应条件不变,增大压强一定可提高平衡时CH3OCH3的选择性 |
| B.其他反应条件不变,改变催化剂,CH3OCH3的选择性不会改变 |
| C.其他反应条件不变,升高温度,CO2的转化率一定随着温度的升高而降低 |
| D.其他反应条件不变,提高投料时的氢碳比[n(H2):nCO2)],能提高CO2平衡转化率 |
(6)某乙烯熔融碳酸盐燃料电池工作原理如图所示,则负极上电极反应式为
我国将在2023年前实现碳达峰、2060年前实现碳中和。“碳中和”是指 CO2的排放总量和减少总量相当。CO2的资源化利用能有效减少CO2排放。
I.研究表明CO2与CH4在催化剂存在下可发生反应制得合成气:
CO2(g)+ CH4(g) 2CO(g)+2H2 (g) △H>0
2CO(g)+2H2 (g) △H>0
(1)此反应的活化能Ea(正)___________ Ea(逆)(填“>”、“=”或“<”)。
(2)某温度下,向一恒容密闭容器中充入CO2和CH4发生上述反应,初始时CO2和CH4的分压分别为15kPa、20kPa,一段时间达到平衡后,测得体系压强增加了10kPa,则该反应的平衡常数Kp=___________ (kPa)2(结果保留两位有效数字,用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。
II.CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应①:CO2(g)+H2(g) ⇋CO(g)+H2O(g) △H1= +41.2kJ·mol-1
反应②:2CO2(g)+6H2(g) ⇋CH3OCH3(g)+3H2O(g) △H2
在恒压,CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:CH3OCH3的选择性=
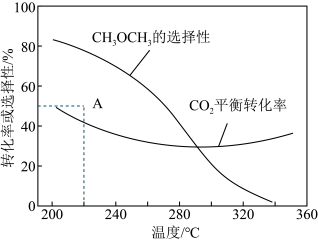
(3)已知反应:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) △H=-204.9kJ·mol-1则反应②的△H2=
CH3OCH3(g)+H2O(g) △H=-204.9kJ·mol-1则反应②的△H2= ___________  ,反应②的自发条件为
,反应②的自发条件为___________ 。
A.高温 B.高压 C.低温 D.低压
(4)温度高于300℃,CO2平衡转化率随温度升高而上升的原因是___________ 。
(5)220℃时,在催化剂作用下CO2与H2反应一段时间 后,测得CH3OCH3的选择性对应图中A点数据。下列说法正确的是___________。
III。
(6)某乙烯熔融碳酸盐燃料电池工作原理如图所示,则负极上电极反应式为___________ 。若要维持电池持续稳定工作,则从理论上讲,进入石墨II电极上的CO2与石墨I电极上生成的CO2的物质的量之比是___________ 。
I.研究表明CO2与CH4在催化剂存在下可发生反应制得合成气:
CO2(g)+ CH4(g)
(1)此反应的活化能Ea(正)
(2)某温度下,向一恒容密闭容器中充入CO2和CH4发生上述反应,初始时CO2和CH4的分压分别为15kPa、20kPa,一段时间达到平衡后,测得体系压强增加了10kPa,则该反应的平衡常数Kp=
II.CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应①:CO2(g)+H2(g) ⇋CO(g)+H2O(g) △H1= +41.2kJ·mol-1
反应②:2CO2(g)+6H2(g) ⇋CH3OCH3(g)+3H2O(g) △H2
在恒压,CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:CH3OCH3的选择性=

(3)已知反应:2CO(g)+4H2(g)
A.高温 B.高压 C.低温 D.低压
(4)温度高于300℃,CO2平衡转化率随温度升高而上升的原因是
(5)220℃时,在催化剂作用下CO2与H2反应
| A.其他反应条件不变,增大压强一定可提高平衡时CH3OCH3的选择性 |
| B.其他反应条件不变,改变催化剂,CH3OCH3的选择性不会改变 |
| C.其他反应条件不变,升高温度,CO2的转化率一定随着温度的升高而降低 |
| D.其他反应条件不变,提高投料时的氢碳比[n(H2):nCO2)],能提高CO2平衡转化率 |
III。
(6)某乙烯熔融碳酸盐燃料电池工作原理如图所示,则负极上电极反应式为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


