填空题 适中0.65 引用4 组卷1110
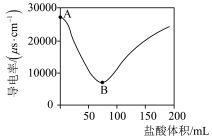
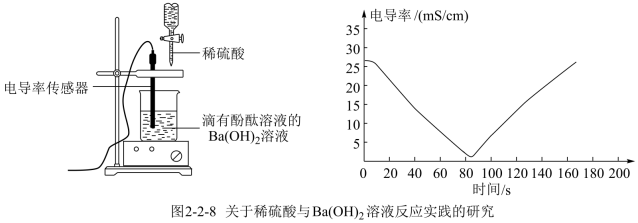
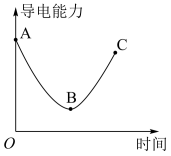
科学研究中观察到的宏观现象能反映微观本质。例如,我们可以通过测定溶液导电能力来探查溶液中自由移动的离子浓度。某小组向0.1 mol/L Ba(OH)2溶液中匀速滴加0.1 mol/L稀硫酸,测得溶液导电能力的变化如图所示,回答下列问题:
资料1:20 ℃时BaSO4溶解度为2.38×10-4 g。
资料2:下表为20 ℃蒸馏水和饱和BaSO4溶液的电导率。
注:电导率越大,溶液导电能力越强。
(1)Ba(OH)2的电离方程式是___________ 。
(2)A~B段发生反应的化学方程式是____________________ 。
(3)关于图中的说法正确的是___________(填字母)。
(4)BaSO4在水中的存在形式,同学们提出了不同的观点:
A.只以BaSO4固体形式存在
B.只以自由移动的SO 和Ba2+形式存在
和Ba2+形式存在
C.主要以BaSO4固体形式存在,同时存在极少量自由移动的SO 和Ba2+
和Ba2+
你支持观点___________ (填字母)证据是____________________ (用文字和数据说明);由此可知,物质在水中的存在形式决定了其在离子方程式中能否写为离子形式。
(5)次磷酸与醋酸相似,是一种易溶于水的一元酸,其分子式为H3PO2,与NaOH溶液反应的离子方程式为:H3PO2+OH-=H2PO +H2O,次磷酸在水中的存在形式是
+H2O,次磷酸在水中的存在形式是___________________ ,次磷酸的电离方程式是___________ 。

资料1:20 ℃时BaSO4溶解度为2.38×10-4 g。
资料2:下表为20 ℃蒸馏水和饱和BaSO4溶液的电导率。
| 蒸馏水 | 饱和BaSO4溶液 | |
| 电导率(S/m) | 1.52×10-3 | 4.58×10-4 |
(1)Ba(OH)2的电离方程式是
(2)A~B段发生反应的化学方程式是
(3)关于图中的说法正确的是___________(填字母)。
| A.AB段溶液的导电能力不断减弱,说明生成的BaSO4不是电解质 |
| B.B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子 |
| C.BC段溶液的导电能力不断增大,主要是由于过量的Ba(OH)2电离出的离子导电 |
| D.a时刻Ba(OH)2溶液与稀硫酸恰好完全中和 |
A.只以BaSO4固体形式存在
B.只以自由移动的SO
C.主要以BaSO4固体形式存在,同时存在极少量自由移动的SO
你支持观点
(5)次磷酸与醋酸相似,是一种易溶于水的一元酸,其分子式为H3PO2,与NaOH溶液反应的离子方程式为:H3PO2+OH-=H2PO
22-23高一上·河南洛阳·期中
类题推荐
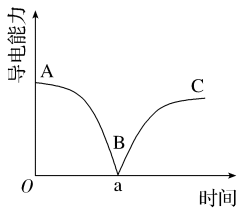
某兴趣小组的同学对Ba(OH)2溶液与稀硫酸反应实质进行探究,并测得混合液的导电率随时间变化曲线如图所示。
(1)写出Ba(OH)2溶液与稀硫酸反应的离子方程式:___________
(2)该小组同学关于该图的下列说法中,正确的是___________
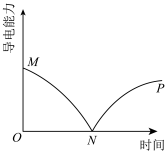
(3)某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀盐酸 ,并测得混合溶液的导电能力随时间变化的曲线如图所示。
①AB段发生反应的离子方程式为___________
②B处Ba(OH)2和稀盐酸恰好完全中和,此时溶液中大量存在的微粒有H2O、___________
③下列化学反应的实质与Ba(OH)2和稀盐酸反应的实质相同的是___________
A.Ba(OH)2溶液与醋酸 B.NaOH溶液与HNO3 C.KOH与NaHSO4

(1)写出Ba(OH)2溶液与稀硫酸反应的离子方程式:
(2)该小组同学关于该图的下列说法中,正确的是___________
| A.0-80s溶液的导电能力不断减弱,说明生成的BaSO4不是电解质 |
| B.80s处的导电能力基本为0,说明溶液中几乎没有自由移动的离子 |
| C.80s之后溶液的导电能力不断增大,主要是由于过量的Ba(OH)2电离出的离子导电 |
| D.NaHSO4溶液与Ba(OH)2恰好中和与该反应恰好中和的离子方程式相同 |

①AB段发生反应的离子方程式为
②B处Ba(OH)2和稀盐酸恰好完全中和,此时溶液中大量存在的微粒有H2O、
③下列化学反应的实质与Ba(OH)2和稀盐酸反应的实质相同的是
A.Ba(OH)2溶液与醋酸 B.NaOH溶液与HNO3 C.KOH与NaHSO4
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网