解答题-工业流程题 适中0.65 引用1 组卷466
海洋是巨大的资源宝库,可以制取多种物质。
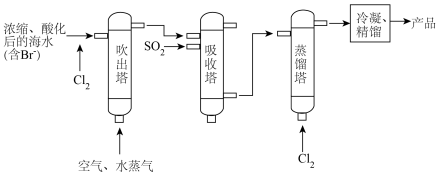
I.海水提溴
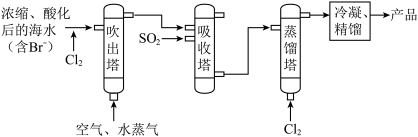
(1)吹出塔中采用气-液逆流的方式(液体从塔顶喷淋,气体从塔底进入),其目的是_______ 。
(2)请写出吸收塔中反应的离子方程式___________ 。
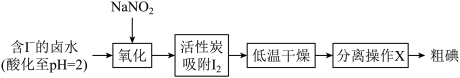
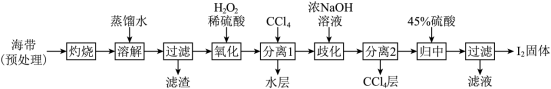
II.海带提碘(海带中碘元素以I-形式存在)
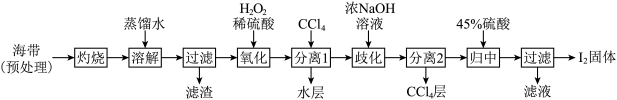
(3)“氧化”过程涉及到的离子方程式是_________ ,请设计一种检验所得溶液含I2的方法:___________ 。
(4)加入浓NaOH溶液充分振荡,发生的歧化反应中氧化剂和还原剂物质的量之比为________ ;向分离得到的含I-和 的水溶液中加入45%硫酸,发生归中反应的离子方程式为
的水溶液中加入45%硫酸,发生归中反应的离子方程式为________ 。
(5)图1是制取碘单质的原电池装置,图2是利用碘研制的新型的锌-碘溴液流电池(图中贮液器可储存电解质溶液,增加电池容量)。
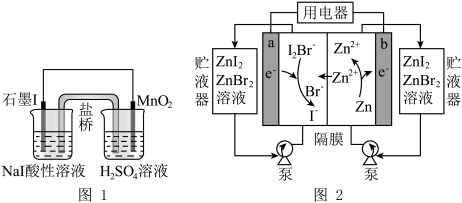
图1中,MnO2极发生的电极反应式为_______ ;图2中,放电时,a电极反应式为________ ,b电极质量减少6.5g时,a电极室增加________ mol离子(不考虑电极室与贮液器的溶液交换)。
I.海水提溴

(1)吹出塔中采用气-液逆流的方式(液体从塔顶喷淋,气体从塔底进入),其目的是
(2)请写出吸收塔中反应的离子方程式
II.海带提碘(海带中碘元素以I-形式存在)

(3)“氧化”过程涉及到的离子方程式是
(4)加入浓NaOH溶液充分振荡,发生的歧化反应中氧化剂和还原剂物质的量之比为
(5)图1是制取碘单质的原电池装置,图2是利用碘研制的新型的锌-碘溴液流电池(图中贮液器可储存电解质溶液,增加电池容量)。

图1中,MnO2极发生的电极反应式为
22-23高一下·四川成都·期末
类题推荐
碘是国防、工业、农业、医药等部门和行业所依赖的重要原料,海水提碘是从海藻中提取元素碘的技术。
Ⅰ.海带提碘(海带中碘元素以I-形式存在)
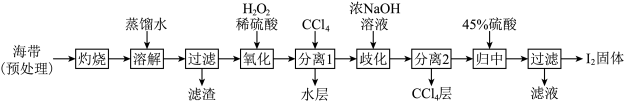
(1)“氧化”过程涉及到的离子方程式是________ ,请设计一种检验氧化后所得溶液含I2的方法:________ 。
(2)加入浓NaOH溶液充分振荡,发生的歧化反应中氧化剂和还原剂物质的量之比为________ ;向分离得到的含I-和 的水溶液中加入45%硫酸,发生归中反应的离子方程式为
的水溶液中加入45%硫酸,发生归中反应的离子方程式为________ 。
Ⅱ.获取重要的还原剂-HI
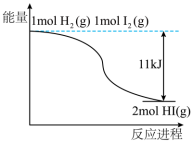
(3)H2和I2反应生成HI过程能量变化如图所示,1molH2(g)、1molHI(g)分子中化学键断裂时分别要吸收能量436kJ、299kJ,则1molI2(g)分子中化学键断裂时需吸收的能量为________ kJ。

(4)Bodensteins研究了反应: 。温度为T时,在体积均为10L的密闭容器中进行实验,测得气体混合物中氢气的物质的量与反应时间t的关系如表:
。温度为T时,在体积均为10L的密闭容器中进行实验,测得气体混合物中氢气的物质的量与反应时间t的关系如表:
前40min的平均速率v(HI)=________ 。
Ⅲ.生命延续-心脏起搏器中的Li-I2电池
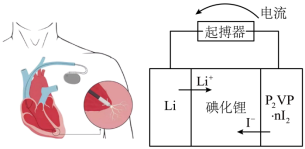
(5)优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极材料是聚2-乙烯吡啶(简写P2VP)和I2的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为 ,其工作原理如图所示:
,其工作原理如图所示:
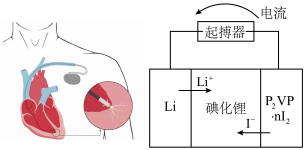
①正极发生的电极反应式为________ ;
②放电时,转移0.6×6.02×1023个电子,负极质量减少________ g。
Ⅰ.海带提碘(海带中碘元素以I-形式存在)

(1)“氧化”过程涉及到的离子方程式是
(2)加入浓NaOH溶液充分振荡,发生的歧化反应中氧化剂和还原剂物质的量之比为
Ⅱ.获取重要的还原剂-HI
(3)H2和I2反应生成HI过程能量变化如图所示,1molH2(g)、1molHI(g)分子中化学键断裂时分别要吸收能量436kJ、299kJ,则1molI2(g)分子中化学键断裂时需吸收的能量为

(4)Bodensteins研究了反应:
| 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 |
| 1molH2(g)、1molI2(g) | n(H2)mol | 1 | 0.5 | 0.32 | 0.24 | 0.20 |
Ⅲ.生命延续-心脏起搏器中的Li-I2电池
(5)优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极材料是聚2-乙烯吡啶(简写P2VP)和I2的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为

①正极发生的电极反应式为
②放电时,转移0.6×6.02×1023个电子,负极质量减少
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网