填空题 较难0.4 引用2 组卷434
铈(Ce)是一种典型的稀土元素,属于国家战略资源。以某废料(主要含 ,还含少量
,还含少量 、
、 、
、 及微量MnO)为原料可制备无水氯化铈
及微量MnO)为原料可制备无水氯化铈 ,主要步骤如下:
,主要步骤如下:
(1)酸浸:用稀硫酸和双氧水的混合溶液浸取废料粉末,浸取液中含有 、
、 、
、 、
、 等金属阳离子。已知
等金属阳离子。已知 不溶于水,写出其发生反应的离子方程式:
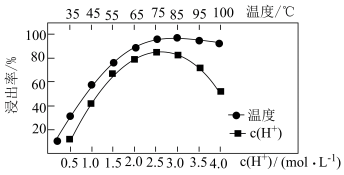
不溶于水,写出其发生反应的离子方程式:________ 。Ce的浸出率与 、温度的关系如图所示。生产中应选择的适宜条件为
、温度的关系如图所示。生产中应选择的适宜条件为________ 。
(2)除杂:向浸出液中加入NaOH溶液调节pH除去 、
、 。注:当
。注:当 时,
时, 沉淀开始溶解。有关沉淀数据(25℃)如下表(“完全沉淀”时金属离子浓度
沉淀开始溶解。有关沉淀数据(25℃)如下表(“完全沉淀”时金属离子浓度 )。
)。
则 的
的
________ ,若浸取液中 ,则须调节溶液pH的范围是
,则须调节溶液pH的范围是________ (加入NaOH溶液过程忽略体积变化)。
(3)萃取与反萃取:向除杂后的溶液中,加入有机物HT,发生反应: (水层)+3HT(有机层)
(水层)+3HT(有机层) (有机层)
(有机层) (水层)。向分离所得有机层中加入
(水层)。向分离所得有机层中加入_______ 能获得较纯的 溶液。
溶液。
结晶析出:将 溶液蒸发浓缩、冷却结晶,过滤,得到
溶液蒸发浓缩、冷却结晶,过滤,得到 晶体。
晶体。
(4)加热脱水:将 固体和
固体和 混合,在真空中加热可得无水
混合,在真空中加热可得无水 。加入
。加入 固体的作用是
固体的作用是________ 。
(5)对 样品纯度进行测定的方法:准确称取样品62.50g,配成1000mL溶液,取50.00mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵
样品纯度进行测定的方法:准确称取样品62.50g,配成1000mL溶液,取50.00mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵 溶液使
溶液使 被氧化为
被氧化为 ,萃取剂萃取
,萃取剂萃取 ,再用
,再用 标准溶液滴定至终点,重复2~3次,平均消耗标准液10.00mL,则
标准溶液滴定至终点,重复2~3次,平均消耗标准液10.00mL,则 样品的纯度为
样品的纯度为________ %(保留小数点后两位)。
(1)酸浸:用稀硫酸和双氧水的混合溶液浸取废料粉末,浸取液中含有

(2)除杂:向浸出液中加入NaOH溶液调节pH除去
沉淀 | ||||
恰好完全沉淀时pH | 5.2 | 2.8 | 9.0 | 10.1 |
(3)萃取与反萃取:向除杂后的溶液中,加入有机物HT,发生反应:
结晶析出:将
(4)加热脱水:将
(5)对
22-23高三上·辽宁·期末
类题推荐
中国的稀土资源十分丰富,有开采价值的储量居世界第一。某实验小组拟利用含铝、硅、铁等杂质的氟碳钵矿(主要成分为CeFCO3)制备三氯化铈,设计如图所示流程:
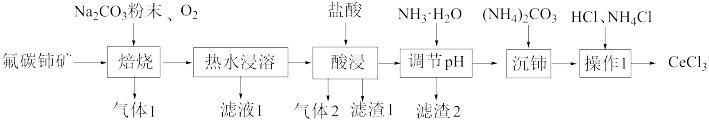
已知:①Ce2O3在加热条件下能被氧气氧化,生成难溶于水、具有强氧化性的CeO2。
②M(CeCl3)=246.5g/mol,在水溶液中Ce4+能被还原成Ce3+。
③0.1mol·L-1金属阳离子形成氢氧化物沉淀的pH如下:
回答下列问题:
(1)氟碳铈矿中铈的化合价为______ ,滤渣1的化学式为__________ 。
(2)焙烧氟碳铈矿生成CeO3的化学方程式是____________ 。
(3)酸浸时产生气体2的离子反应方程式是_______ 。
(4)为将铝、铁以滤渣2除去,用NH3·H2O调节酸浸后溶液的pH最大不能超过______ 。
(5)将沉铈得到的Ce2(CO3)3·nH2O洗涤干净后继续进行操作I,简述如何证明Ce2(CO3)3·nH2O已经洗涤干净________ 。
(6)操作I是将得到的Ce2(CO3)3·nH2O加盐酸至沉淀完全溶解,先经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到CeCl3·7H2O,再将该晶体与NH4Cl固体隔绝空气共热,得到无水CeCl3。其中,NH4Cl的作用是___________ 。
(7)产品纯度测定:准确称取CeCl3产品0.3750g于锥形瓶中,加入合适的氧化剂将Ce3+恰好完全氧化为Ce4+,再用0.1000mol/L的(NH4)2Fe(SO4)2 标准溶液滴定至终点,重复3次实验,标准液的消耗体积分别为12.48mL、12.50mL、12.52mL。求该样品的质量分数为_______ (保留1位小数)。

已知:①Ce2O3在加热条件下能被氧气氧化,生成难溶于水、具有强氧化性的CeO2。
②M(CeCl3)=246.5g/mol,在水溶液中Ce4+能被还原成Ce3+。
③0.1mol·L-1金属阳离子形成氢氧化物沉淀的pH如下:
| 金属阳离子 | Fe3+ | Ce3+ | Al3+ |
| 开始沉淀的pH | 1.5 | 7.6 | 3.4 |
| 沉淀完全的pH | 2.8 | 9.4 | 4.7 |
(1)氟碳铈矿中铈的化合价为
(2)焙烧氟碳铈矿生成CeO3的化学方程式是
(3)酸浸时产生气体2的离子反应方程式是
(4)为将铝、铁以滤渣2除去,用NH3·H2O调节酸浸后溶液的pH最大不能超过
(5)将沉铈得到的Ce2(CO3)3·nH2O洗涤干净后继续进行操作I,简述如何证明Ce2(CO3)3·nH2O已经洗涤干净
(6)操作I是将得到的Ce2(CO3)3·nH2O加盐酸至沉淀完全溶解,先经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到CeCl3·7H2O,再将该晶体与NH4Cl固体隔绝空气共热,得到无水CeCl3。其中,NH4Cl的作用是
(7)产品纯度测定:准确称取CeCl3产品0.3750g于锥形瓶中,加入合适的氧化剂将Ce3+恰好完全氧化为Ce4+,再用0.1000mol/L的(NH4)2Fe(SO4)2 标准溶液滴定至终点,重复3次实验,标准液的消耗体积分别为12.48mL、12.50mL、12.52mL。求该样品的质量分数为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2CuO+TeO2。
2CuO+TeO2。


