解答题-实验探究题 困难0.15 引用1 组卷407
某小组对Cu和 的反应进行相关实验探究。
的反应进行相关实验探究。
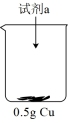
【实验探究】实验i:向装有0.5gCu的烧杯中加入 溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)写出该反应的化学方程式:___________ 。
【继续探究】针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
(2)实验ii中:溶液变蓝的原因是___________ (用离子反应方程式表示);经检验产生的气体为氧气,产生氧气先慢后快的原因是___________ 。(不考虑温度的影响)。
(3)对比实验i和iii,为探究氨水对Cu的还原性或 氧化性的影响,该同学利用如图装置继续实验。
氧化性的影响,该同学利用如图装置继续实验。
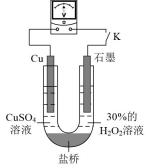
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
①解释步骤c中电压增大的原因:___________ 。
②若向U型管左侧溶液中滴加硫酸后,电压不变,继续向U型管右侧溶液中滴加硫酸后,电压增大了z。则可以得出的结论是:___________ 。
(4)基于以上实验,影响Cu与 反应的因素有
反应的因素有___________ 。(任写一条)
(5)结合上述实验,下列说法正确的是___________ 。
A.电化学是研究物质氧化性、还原性的重要手段之一
B.实验ii中发生的反应中, 只体现氧化性
只体现氧化性
C.在还原反应(氧化反应)中,增大反应物浓度或降低生成物浓度,氧化剂(还原剂)的氧化性(还原性)增强
【实验探究】实验i:向装有0.5gCu的烧杯中加入
(1)写出该反应的化学方程式:
【继续探究】针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
| 装置 | 序号 | 试剂a | 现象 |
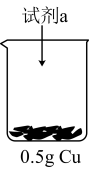 | ii | Cu表面产生少量气泡,溶液逐渐变蓝,后产生较多气泡 | |
| iii | 溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物 |
(3)对比实验i和iii,为探究氨水对Cu的还原性或

已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
①解释步骤c中电压增大的原因:
②若向U型管左侧溶液中滴加硫酸后,电压不变,继续向U型管右侧溶液中滴加硫酸后,电压增大了z。则可以得出的结论是:
(4)基于以上实验,影响Cu与
(5)结合上述实验,下列说法正确的是
A.电化学是研究物质氧化性、还原性的重要手段之一
B.实验ii中发生的反应中,
C.在还原反应(氧化反应)中,增大反应物浓度或降低生成物浓度,氧化剂(还原剂)的氧化性(还原性)增强
23-24高三上·广东·阶段练习
类题推荐
某小组探究Cu和H2O2的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
【实验探究】
实验i:向装有0.5g Cu的烧杯中加入20mL30% H2O2溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)①写出该反应的化学方程式:_______ 。
②电极反应式:
ⅰ.氧化反应:_______ 。
ⅱ.还原反应: H2O2+ 2e- = 2OH-
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
(2)实验ii中:溶液变蓝的原因是_______ (用化学方程式表示)。
(3)对比实验i和iii,为探究浓氨水对Cu的还原性或H2O2氧化性的影响,该同学利用下图装置继续实验。
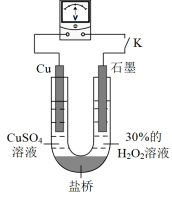
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加浓氨水后,电压减小了y。
c.继续向U型管左侧溶液中滴加浓氨水后,电压增大了z。
①从电极反应角度解释产生现象c的原因:_______ 。
②利用该方法也可证明酸性增强可提高H2O2的氧化性,具体实验操作及现象是_______ 。
(4)总结:物质氧化性和还原性变化的一般规律是_______ 。
【实验探究】
实验i:向装有0.5g Cu的烧杯中加入20mL30% H2O2溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)①写出该反应的化学方程式:
②电极反应式:
ⅰ.氧化反应:
ⅱ.还原反应: H2O2+ 2e- = 2OH-
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
| 装置 | 序号 | 试剂a | 现象 |
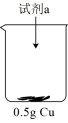 | ii | 20mL30% H2O2与4mL5mol/L H2SO4混合液 | Cu表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
| iii | 20mL30% H2O2与4mL5mol/L氨水混合液 | 溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物 |
(3)对比实验i和iii,为探究浓氨水对Cu的还原性或H2O2氧化性的影响,该同学利用下图装置继续实验。

已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加浓氨水后,电压减小了y。
c.继续向U型管左侧溶液中滴加浓氨水后,电压增大了z。
①从电极反应角度解释产生现象c的原因:
②利用该方法也可证明酸性增强可提高H2O2的氧化性,具体实验操作及现象是
(4)总结:物质氧化性和还原性变化的一般规律是
某小组同学探究Cu和H2O2的反应。
【猜想预测】
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
【实验探究】
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:________ 。
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2++ 4NH3⇌[ Cu(NH3)4]2+,[ Cu(NH3)4]2+为深蓝色;Cu(OH)2可溶于氨水形成深蓝色溶液。
(2)实验ⅱ中:溶液变蓝的原因是________ (用化学用语解释);经检验产生的气体为氧气,产生氧气的原因是________ 。
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用如图装置继续实验。
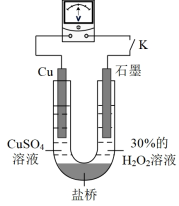
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U形管右侧溶液中滴加氨水后,电压不变。
c.继续向U形管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论:_________ 。利用该方法也可证明酸性增强可提高H2O2的氧化性,导致Cu溶解速率加快。
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是_______ 。
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:________ 。
(6)基于以上实验,影响Cu与H2O2反应速率的因素有________ 。
【猜想预测】
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
【实验探究】
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2++ 4NH3⇌[ Cu(NH3)4]2+,[ Cu(NH3)4]2+为深蓝色;Cu(OH)2可溶于氨水形成深蓝色溶液。
| 装置 | 序号 | 试剂a | 现象 |
 | ⅱ | 20 mL 30% H2O2与4 mL 5 mol/L H2SO4混合液 | Cu表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
| ⅲ | 20 mL 30% H2O2与4 mL5 mol/L氨水混合液 | 溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物 |
(2)实验ⅱ中:溶液变蓝的原因是
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用如图装置继续实验。

已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U形管右侧溶液中滴加氨水后,电压不变。
c.继续向U形管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论:
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:
(6)基于以上实验,影响Cu与H2O2反应速率的因素有
某小组同学通过下列实验探究了物质的溶解度大小、反应物浓度与沉淀转化方向之间的关系。
已知:
(1)探究BaCO3和BaSO4之间的转化
实验操作:
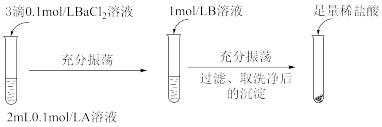
①实验Ⅰ中加入A溶液后生成沉淀的离子方程式为_____________ 。
②实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因________ 。
(2)探究AgCl和AgI之间的转化
实验Ⅲ:
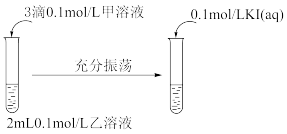
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①实验Ⅲ证明了AgCl转化为AgI,甲溶液是_____________ (填序号)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
②实验Ⅳ中结合信息,解释电压b<a的原因:_____________ 。
③实验Ⅳ的现象能说明AgI转化为AgCl,理由是_____________ 。
(3)综合实验Ⅰ~Ⅳ,下列说法正确的是_____________ (填序号)。
a. 溶解度小的沉淀只能转化成溶解度更小的沉淀
b. 电化学是研究物质性质和转化的重要手段之一
c. 某些沉淀转化反应可通过对反应物浓度的调节,实现逆向转化
d. 溶解度差别越大,由溶解度小的沉淀转化为溶解度较大的沉淀越难实现
已知:
| 物质 | BaSO4 | BaCO3 | AgI | AgCl |
| 溶解度/g(20℃) |
实验操作:

| 试剂A | 试剂B | 加入盐酸后的现象 | |
| 实验Ⅰ | Na2CO3 | Na2SO4 | 无明显现象 |
| 实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
②实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因
(2)探究AgCl和AgI之间的转化
实验Ⅲ:
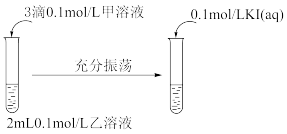
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
| 装置 | 步骤 | 电压表读数 |
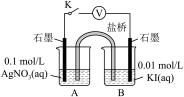 | i. 如图连接装置并加入试剂,闭合K | a |
| ii. 向B中滴入AgNO3(aq),至沉淀完全 | b | |
| iii. 再向B中投入一定量NaCl(s) | c | |
| iv. 重复i,再向B中加入与iii等量NaCl(s) | a |
①实验Ⅲ证明了AgCl转化为AgI,甲溶液是
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
②实验Ⅳ中结合信息,解释电压b<a的原因:
③实验Ⅳ的现象能说明AgI转化为AgCl,理由是
(3)综合实验Ⅰ~Ⅳ,下列说法正确的是
a. 溶解度小的沉淀只能转化成溶解度更小的沉淀
b. 电化学是研究物质性质和转化的重要手段之一
c. 某些沉淀转化反应可通过对反应物浓度的调节,实现逆向转化
d. 溶解度差别越大,由溶解度小的沉淀转化为溶解度较大的沉淀越难实现
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


