解答题-工业流程题 适中0.65 引用1 组卷247
五氧化二钒(V2O5)广泛用于冶金、化工等行业,可用作合金添加剂、生产硫酸或石油精炼用的催化剂等。从废钒催化剂(主要成分为V2O5、V2O4、K2SO4、SiO2、Fe2O3)中回收V2O5的工艺流程如图所示:
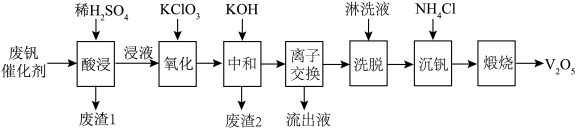
已知:①钒的氧化物在酸性条件下以 、VO2+存在;
、VO2+存在;
②“离子交换”和“洗脱”过程可简单表示为4ROH+V4O
 R4V4O12+4OH−。
R4V4O12+4OH−。
(1)废渣1的主要成分为___________ ,浸液中钒的存在形式为___________ (填离子符号)。
(2)“氧化”过程中发生的化学方程式为___________ 。
(3)“中和”过程中,含钒离子发生反应的离子方程式为___________ 。
(4)“离子交换”时,应选择___________ (填“阳离子”或“阴离子”)交换树脂。
(5)“沉钒”过程中获得沉淀Y的摩尔质量为598 g·mol−1,且仅含有四种元素。取59.8g沉淀Y的样品充分焙烧,得到产品54.6g,将产生的气体通过足量碱石灰,碱石灰增重1.8g,剩余的气体再通入稀硫酸被完全吸收。通过计算确定沉淀Y的化学式为___________ 。
(6)测定产品中V2O5的纯度:称取ag产品,先用硫酸溶解,得到(VO2)SO4溶液。 再加b1mL c1 mol·L−1 (NH4)2Fe(SO4)2溶液( +2H++Fe2+=VO2++Fe3++H2O)。最后用c2 mol·L−1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO4−被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182g·mol−1)的质量分数是
+2H++Fe2+=VO2++Fe3++H2O)。最后用c2 mol·L−1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO4−被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182g·mol−1)的质量分数是___________ 。

已知:①钒的氧化物在酸性条件下以
②“离子交换”和“洗脱”过程可简单表示为4ROH+V4O
(1)废渣1的主要成分为
(2)“氧化”过程中发生的化学方程式为
(3)“中和”过程中,含钒离子发生反应的离子方程式为
(4)“离子交换”时,应选择
(5)“沉钒”过程中获得沉淀Y的摩尔质量为598 g·mol−1,且仅含有四种元素。取59.8g沉淀Y的样品充分焙烧,得到产品54.6g,将产生的气体通过足量碱石灰,碱石灰增重1.8g,剩余的气体再通入稀硫酸被完全吸收。通过计算确定沉淀Y的化学式为
(6)测定产品中V2O5的纯度:称取ag产品,先用硫酸溶解,得到(VO2)SO4溶液。 再加b1mL c1 mol·L−1 (NH4)2Fe(SO4)2溶液(
22-23高一上·山东东营·期末
类题推荐
五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如下:
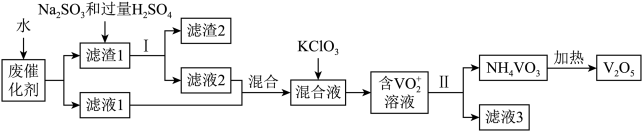
已知:a.部分含钒物质常温下在水中的溶解性如下表所示:
b. +2OH-
+2OH-
 +H2O
+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为_________ (写一条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为_______________ (填离子符号)。
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式为_____________ 。
(4)生成VO2+的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式为________________
(5)结合化学用语,用平衡移动原理解释加入氨水的一种作用为__________________
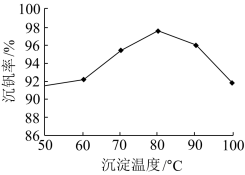
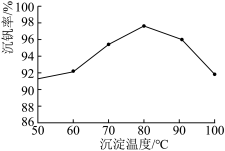
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。请解释下图温度超过80℃以后,沉钒率下降的可能原因是________________________ ;___________________ (写两条)。
(7)该工艺流程中可以循环利用的物质为__________________ 。
(8)测定产品中V2O5的纯度:称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L−1 (NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+==VO2++Fe3++H2O)。最后用c2 mol·L−1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182 g·mol−1)的质量分数是______ 。(列出计算式)

已知:a.部分含钒物质常温下在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
b.
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式为
(4)生成VO2+的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式为
(5)结合化学用语,用平衡移动原理解释加入氨水的一种作用为
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。请解释下图温度超过80℃以后,沉钒率下降的可能原因是

(7)该工艺流程中可以循环利用的物质为
(8)测定产品中V2O5的纯度:称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L−1 (NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+==VO2++Fe3++H2O)。最后用c2 mol·L−1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182 g·mol−1)的质量分数是
五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如下:
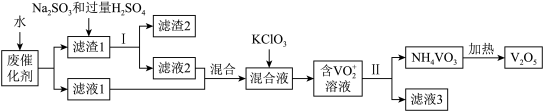
已知:①部分含钒物质常温下在水中的溶解性如表所示:
②VO2++2OH- VO3-+H2O
VO3-+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为____________ (写一条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为____________ (填离子符号)。
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式为____________ 。
(4)生成VO2+的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式为____________ 。
(5)在第Ⅱ步中需要加入氨水,请结合化学用语,用平衡移动原理解释加入氨水的一种作用为____________ 。
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。请结合如图解释在第Ⅱ步中温度超过80°C以后,沉钒率下降的可能原因是____________ ;____________ (写两条)。
(7)该工艺流程中可以循环利用的物质为____________ 。
(8)测定产品中V2O5的纯度:
称取ag产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1mLc1mol·L−1(NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+==VO2++Fe3++H2O)。最后用c2mol·L−1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO4-被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182g·mol−1)的质量分数是____________ 。(列出计算式)

已知:①部分含钒物质常温下在水中的溶解性如表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
②VO2++2OH-
 VO3-+H2O
VO3-+H2O回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式为
(4)生成VO2+的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式为
(5)在第Ⅱ步中需要加入氨水,请结合化学用语,用平衡移动原理解释加入氨水的一种作用为
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。请结合如图解释在第Ⅱ步中温度超过80°C以后,沉钒率下降的可能原因是

(7)该工艺流程中可以循环利用的物质为
(8)测定产品中V2O5的纯度:
称取ag产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1mLc1mol·L−1(NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+==VO2++Fe3++H2O)。最后用c2mol·L−1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO4-被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182g·mol−1)的质量分数是
五氧化二钒(V2O5)广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5新工艺流程如图:

已知:a.部分含钒物质常温下在水中溶解性如表所示:
b.VO +2OH-
+2OH- VO
VO +H2O
+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为____ (写两条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为_____ (填离子符号)。
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式:____ 。
(4)生成VO 的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式:
的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式:____ 。
(5)在第II步反应中需要加入氨水,结合化学用语,用平衡移动原理解释加入氨水的一种作用为_____ 。
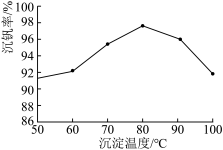
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂中V的质量之比)表示该步反应钒的回收率。请解释如图温度超过80℃以后,沉钒率下降的可能原因是:____ (写一条即可)。
(7)测定产品中V2O5的纯度:称取ag产品,先用硫酸溶解,得到(VO2)SO4溶液。再加b1mLc1mol•L-1(NH4)2Fe(SO4)2溶液(VO +2H++Fe2+=VO2++Fe3++H2O)。最后用c2mol•L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO
+2H++Fe2+=VO2++Fe3++H2O)。最后用c2mol•L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO 被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182g•mol-1)的质量分数是
被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182g•mol-1)的质量分数是____ 。(列出计算式)

已知:a.部分含钒物质常温下在水中溶解性如表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
b.VO
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式:
(4)生成VO
(5)在第II步反应中需要加入氨水,结合化学用语,用平衡移动原理解释加入氨水的一种作用为
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂中V的质量之比)表示该步反应钒的回收率。请解释如图温度超过80℃以后,沉钒率下降的可能原因是:

(7)测定产品中V2O5的纯度:称取ag产品,先用硫酸溶解,得到(VO2)SO4溶液。再加b1mLc1mol•L-1(NH4)2Fe(SO4)2溶液(VO
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


