解答题-原理综合题 适中0.65 引用2 组卷216
传统工艺采用酸催化水解苯乙腈(C6H5CH2CN)生产苯乙酸(C6H5CH2COOH),某科研工作者研究了近临界水(250℃~350℃之间的压缩液态水,可同时溶解有机物和无机物)中苯乙腈无外加催化剂水解生成苯乙酸的反应。反应原理为:
反应Ⅰ: (苯乙酰胺)
(苯乙酰胺)
反应Ⅱ:
当反应釜维持压强为8Mpa,苯乙腈的进料浓度为 时,获得如图1、图2所示实验结果。
时,获得如图1、图2所示实验结果。
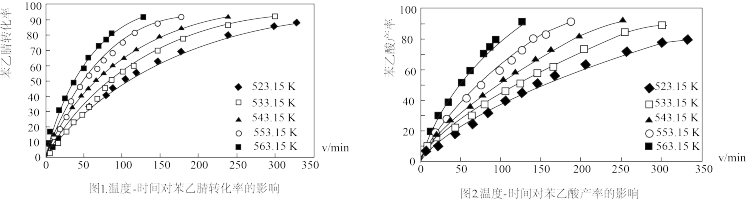
请回答:
(1)反应Ⅱ的
_____ 0(填“>”、“<”或“=”)
(2)关于近临界水、不加催化剂条件的反应工艺说法正确的是_____。
(3)对于物质状态不同的多相反应,其平衡常数表达式中气相物质可用 [
[ 为平衡分压,
为平衡分压, 为标准压强]表示。请写出苯乙腈水解生成苯乙酸总反应的平衡常数表达式K=
为标准压强]表示。请写出苯乙腈水解生成苯乙酸总反应的平衡常数表达式K=_____ :某温度下测得各物质的平衡浓度分别为 ,
, ,忽略苯乙酸的电离及与氨气的作用,则反应Ⅰ的平衡常数的值为
,忽略苯乙酸的电离及与氨气的作用,则反应Ⅰ的平衡常数的值为_____ 。
(4)温度升高,对反应速率的影响更大的是_____ (填“反应Ⅰ”、“反应Ⅱ”)。说明判断依据,并从碰撞理论角度解释原因_____ 。
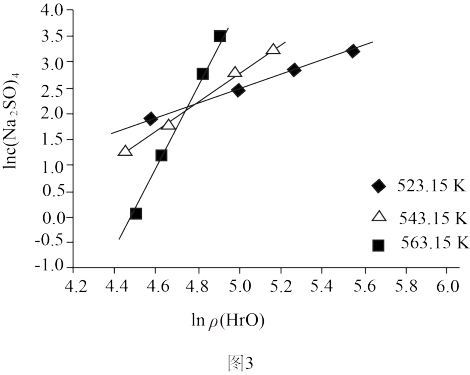
(5)超临界水在有机废物处理过程中会产生二氧化碳、水、氮气以及盐类等无毒的小分子化合物。其中,以硫酸钠为研究对象,基于水合机理的溶解模型描述其溶解过程: ,其中
,其中 为溶解在超临界水中的硫酸钠,r为硫酸钠溶解所需的水分子数。对于这一反应,平衡常数可近似表示为:
为溶解在超临界水中的硫酸钠,r为硫酸钠溶解所需的水分子数。对于这一反应,平衡常数可近似表示为: 。在不同温度下,用硫酸钠溶解度的对数对水密度的对数作图,能得到一系列直线。由图3可以看出,温度变化使得水合分子数发生改变,且温度越来越高,溶解所需的水合分子数r的数值
。在不同温度下,用硫酸钠溶解度的对数对水密度的对数作图,能得到一系列直线。由图3可以看出,温度变化使得水合分子数发生改变,且温度越来越高,溶解所需的水合分子数r的数值_____ (填“增大”、“减小”或“不变”)。
反应Ⅰ:
反应Ⅱ:
当反应釜维持压强为8Mpa,苯乙腈的进料浓度为

请回答:
(1)反应Ⅱ的
(2)关于近临界水、不加催化剂条件的反应工艺说法正确的是_____。
| A.苯乙腈、苯乙酰胺在近临界水中具有更大的溶解度,有利于加快反应速率 |
| B.上述实验条件下,苯乙腈的转化率与温度有关,与反应时间无关 |
| C.近临界水本身的pH<7,水电离的H+起催化作用 |
| D.恒压通入N2有利于提高反应Ⅱ的平衡转化率 |
(4)温度升高,对反应速率的影响更大的是
(5)超临界水在有机废物处理过程中会产生二氧化碳、水、氮气以及盐类等无毒的小分子化合物。其中,以硫酸钠为研究对象,基于水合机理的溶解模型描述其溶解过程:

2021·广东广州·模拟预测
类题推荐
I.25°C时,三种弱电解质的电离平衡常数如下表:
(1)常温下,0.lmol·L-1的NH3·H2O溶液加水稀释过程,下列表达式的数据一定变小的是___________ ;
a.c(OH-) b. c.c(H+)·c(OH-) d.
c.c(H+)·c(OH-) d.
(2)同浓度的①HCOONa②CH3COONa③CH3COONH4④NH4Cl溶液的pH由大到小的顺序为___________ ;(用序号表示)
(3)用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积分别为V1、V2,则V1___________ V2(填“>”、“<“或“=”)。
II.水是“生命之基质”,是“永远值得探究的物质”。
(1)关于反应H2(g)+ O2(g)=H2O(l),下列说法正确的是
O2(g)=H2O(l),下列说法正确的是___________
A.焓变ΔH<0,熵变ΔS>0
B.可以把反应设计成原电池,实现能量的转化
C.选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行
(2)水在高温高压状态下呈现许多特殊的性质。当温度、压强分别超过临界温度(374.2℃)、临界压强(22.1MPa)时的水称为超临界水。
①与常温常压的水相比,高温高压液态水的离子积会显著增大。如果水的离子积Kw从10×10-14增大到1.0×10-10,则相应的电离度是原来的___________ 倍。
②超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定实验条件下,测得乙醇的超临界水氧化结果如图所示,其中x为以碳元素计算的物质的量分数,t为反应时间。
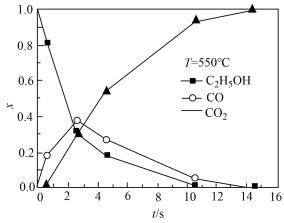
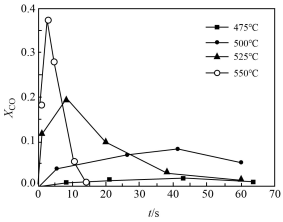
下列说法合理的是___________
A.乙醇的超临界水氧化过程中,一氧化碳是中间产物,二氧化碳是最终产物
B.在550℃条件下,反应时间大于15s时,乙醇氧化为二氧化碳已趋于完全
C.乙醇的超临界水氧化过程中,乙醇的消耗速率或二氧化碳的生成速率都可以用来表示反应的速率,而且两者数值相等
D.随温度升高,xCO峰值出现的时间提前,且峰值更高,说明乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大
| 化学式 | HCOOH | CH3COOH | NH3·H2O |
| 电离平衡常数 | 1.77×10-4 | 1.75×10-5 | 1.76×10-5 |
(1)常温下,0.lmol·L-1的NH3·H2O溶液加水稀释过程,下列表达式的数据一定变小的是
a.c(OH-) b.
(2)同浓度的①HCOONa②CH3COONa③CH3COONH4④NH4Cl溶液的pH由大到小的顺序为
(3)用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积分别为V1、V2,则V1
II.水是“生命之基质”,是“永远值得探究的物质”。
(1)关于反应H2(g)+
A.焓变ΔH<0,熵变ΔS>0
B.可以把反应设计成原电池,实现能量的转化
C.选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行
(2)水在高温高压状态下呈现许多特殊的性质。当温度、压强分别超过临界温度(374.2℃)、临界压强(22.1MPa)时的水称为超临界水。
①与常温常压的水相比,高温高压液态水的离子积会显著增大。如果水的离子积Kw从10×10-14增大到1.0×10-10,则相应的电离度是原来的
②超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定实验条件下,测得乙醇的超临界水氧化结果如图所示,其中x为以碳元素计算的物质的量分数,t为反应时间。


下列说法合理的是
A.乙醇的超临界水氧化过程中,一氧化碳是中间产物,二氧化碳是最终产物
B.在550℃条件下,反应时间大于15s时,乙醇氧化为二氧化碳已趋于完全
C.乙醇的超临界水氧化过程中,乙醇的消耗速率或二氧化碳的生成速率都可以用来表示反应的速率,而且两者数值相等
D.随温度升高,xCO峰值出现的时间提前,且峰值更高,说明乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大
为了缓解温室效应与能源供应之间的冲突,从空气中捕集 并将其转化为燃料或增值化学品成为了新的研究热点,如甲醇的的制备。回答下列问题:
并将其转化为燃料或增值化学品成为了新的研究热点,如甲醇的的制备。回答下列问题:
I.制备合成气:反应 在工业上有重要应用。
在工业上有重要应用。
(1)该反应在不同温度下的平衡常数如表所示。
①反应的ΔH_______ 0(填“>”“<”或“=”)。
②反应常在较高温度下进行,该措施的优缺点是_______ 。
(2)该反应常在Pd膜反应器中进行,其工作原理如图1所示。
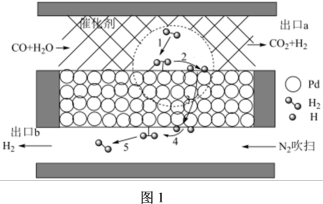
①利用平衡移动原理解释反应器存在Pd膜时具有更高转化率的原因是_______ 。
②某温度下, 在Pd膜表面上的解离过程存在如下平衡:
在Pd膜表面上的解离过程存在如下平衡: ,其正反应的活化能远小于逆反应的活化能。下列说法错误的是
,其正反应的活化能远小于逆反应的活化能。下列说法错误的是_______ (填标号)。
A.Pd膜对气体分子的透过具有选择性
B.过程2的ΔH>0
C.加快Pd膜内H原子迁移有利于 的解离
的解离
D.H原子在Pd膜表面上结合为 的过程为放热反应
的过程为放热反应
Ⅱ.合成甲醇:在体积不变的密闭容器中投入 0.5mol CO 和 1mol H2,不同条件下发生反应:CO(g)+2H2(g) CH3OH(g)。实验测得平衡时H2的转化率随温度、压强的变化如图 2 所示。
CH3OH(g)。实验测得平衡时H2的转化率随温度、压强的变化如图 2 所示。
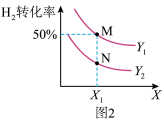
(3)图2中X代表_______ (填“温度”或“压强”)。若图2中M 点对应的容器体积为5 L,则N点的平衡常数K为_______ 。
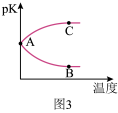
(4)图3中正确表示该反应的平衡常数的负对数pK(pK=−lgK)与X 的关系的曲线_______ (填“AC”或“AB”)。
(5)通过光催化、光电催化或电解水制氢来进行二氧化碳加氢制甲醇(CH3OH),发生的主要反应是CO2(g)+3H2(g) CH3OH(g)+H2O(g)。若二氧化碳加氢制甲醇的反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到 t1时刻达到平衡状态的是
CH3OH(g)+H2O(g)。若二氧化碳加氢制甲醇的反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到 t1时刻达到平衡状态的是_______ (填标号)。
a.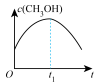 b.
b.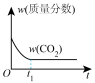 c.
c.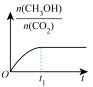 d.
d.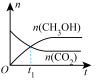
I.制备合成气:反应
(1)该反应在不同温度下的平衡常数如表所示。
| 温度/℃ | 700 | 800 | 830 | 1000 |
| 平衡常数 | 1.67 | 1.11 | 1.00 | 0.59 |
②反应常在较高温度下进行,该措施的优缺点是
(2)该反应常在Pd膜反应器中进行,其工作原理如图1所示。

①利用平衡移动原理解释反应器存在Pd膜时具有更高转化率的原因是
②某温度下,
A.Pd膜对气体分子的透过具有选择性
B.过程2的ΔH>0
C.加快Pd膜内H原子迁移有利于
D.H原子在Pd膜表面上结合为
Ⅱ.合成甲醇:在体积不变的密闭容器中投入 0.5mol CO 和 1mol H2,不同条件下发生反应:CO(g)+2H2(g)

(3)图2中X代表
(4)图3中正确表示该反应的平衡常数的负对数pK(pK=−lgK)与X 的关系的曲线

(5)通过光催化、光电催化或电解水制氢来进行二氧化碳加氢制甲醇(CH3OH),发生的主要反应是CO2(g)+3H2(g)
a.
 b.
b. c.
c. d.
d.
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)  2NH3(g) △H=-92.4 kJ/mol 据此回答以下问题:
2NH3(g) △H=-92.4 kJ/mol 据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是___________ (填序号)。
①反应压强为20Mpa~50Mpa ②500℃的高温 ③铁触媒作催化剂 ④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
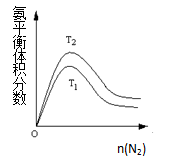
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2______ T1(填>、=、<),判断的依据是:_______
(3)合成氨气所需的氢气可以由水煤气分离得到。涉及反应信息如下:
反应一:C(s)+H2O(g) H2(g)+CO(g) 平衡常数K1
H2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2
H2(g)+CO2(g) 平衡常数K2
① K1的表达式:K1=___________
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
(Ⅰ)实验1中,用CO2表示反应开始到平衡的平均反应速率为___________
(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为___________ (填序号)
A.其它条件不变温度T<900℃ B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2___________ (填“增大”、“减小”或“不变”)。
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是
①反应压强为20Mpa~50Mpa ②500℃的高温 ③铁触媒作催化剂 ④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2

(3)合成氨气所需的氢气可以由水煤气分离得到。涉及反应信息如下:
反应一:C(s)+H2O(g)
反应二:CO(g)+H2O(g)
① K1的表达式:K1=
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为
A.其它条件不变温度T<900℃ B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


