解答题-原理综合题 适中0.65 引用1 组卷48
硫的氧化物的排放是形成硫酸型酸雨的主要原因,含硫烟气(主要成分为SO2)的处理备受关注,主要有以下两种方法。请回答下列问题:
I.碱液吸收法
步骤1:用足量氨水吸收SO2。
步骤2:再加入熟石灰,发生反应2NH +Ca2++2OH-+SO
+Ca2++2OH-+SO ⇌CaSO3↓+2NH3•H2O。
⇌CaSO3↓+2NH3•H2O。
(1)已知:25℃时,Kb(NH3•H2O)=a;Ksp(CaSO3)=b。该温度下,步骤2中反应的平衡常数K=________ (用含a、b的代数式表示)。
Ⅱ.水煤气还原法
已知:
i.2CO(g)+SO2(g)⇌S(l)+2CO2(g)ΔH1═-37.0kJ•mol-1
ii.2H2(g)+SO2(g)⇌S(l)+2H2O(g)ΔH2=+45.4kJ•mol-1
(2)CO(g)与H2O(g)反应生成CO2(g)、H2(g)的热化学方程式为________ 。
(3)在一定压强下,发生反应ii。平衡时,SO2的转化率α(SO2)与原料气投料比[ ]和温度(T)的关系如图所示。
]和温度(T)的关系如图所示。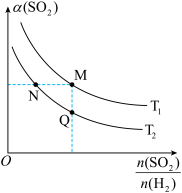 ①H2的转化率α(H2):M
①H2的转化率α(H2):M______ N(填“>”“<”或“=”)。
②逆反应速率:Q______ M(填“>”“<”或“=”)。
(4)T℃,向2L恒容密闭容器中充入2molCO(g)、2molSO2(g)和2molH2(g),发生反应i和反应ii。5min达到平衡时,CO2(g)和H2O(g)的物质的量分别为1.6mol、1.8mol。
①其他条件不变,6min时缩小容器容积,α(H2)________ (填“增大”“减小”或“不变)。
②该温度下,反应ii的平衡常数K=________ 。
I.碱液吸收法
步骤1:用足量氨水吸收SO2。
步骤2:再加入熟石灰,发生反应2NH
(1)已知:25℃时,Kb(NH3•H2O)=a;Ksp(CaSO3)=b。该温度下,步骤2中反应的平衡常数K=
Ⅱ.水煤气还原法
已知:
i.2CO(g)+SO2(g)⇌S(l)+2CO2(g)ΔH1═-37.0kJ•mol-1
ii.2H2(g)+SO2(g)⇌S(l)+2H2O(g)ΔH2=+45.4kJ•mol-1
(2)CO(g)与H2O(g)反应生成CO2(g)、H2(g)的热化学方程式为
(3)在一定压强下,发生反应ii。平衡时,SO2的转化率α(SO2)与原料气投料比[
 ①H2的转化率α(H2):M
①H2的转化率α(H2):M②逆反应速率:Q
(4)T℃,向2L恒容密闭容器中充入2molCO(g)、2molSO2(g)和2molH2(g),发生反应i和反应ii。5min达到平衡时,CO2(g)和H2O(g)的物质的量分别为1.6mol、1.8mol。
①其他条件不变,6min时缩小容器容积,α(H2)
②该温度下,反应ii的平衡常数K=
20-21高二下·广西南宁·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网