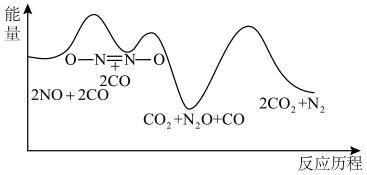
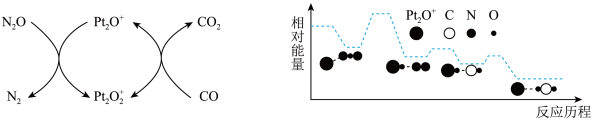
解答题-原理综合题 适中0.65 引用1 组卷138
完成下列问题。
(1)已知:①N2(g)+O2(g) 2NO(g) △H1=+180kJ•mol-1
2NO(g) △H1=+180kJ•mol-1
②C(s)+O2(g)=CO2(g) △H2=-393kJ•mol-1
③2C(s)+O2(g)=2CO(g) △H3=-221kJ•mol-1
若某反应的平衡常数表达式为 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:______ 。
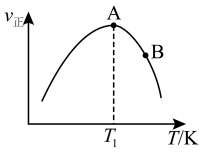
(2)欲研究在某催化剂作用下2CO(g)+2NO(g) N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如图所示,A、B两点对应温度下正反应速率变化的原因可能是
N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如图所示,A、B两点对应温度下正反应速率变化的原因可能是______ ,A、B两点对应温度下该反应的活化能Ea(A)______ Ea(B)(填“>”或“<”)。
(3)设 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数 =
=___________ 。
(4)用NH3可以消除NO污染:4NH3(g)+6NO(g) 5N2(g)+6H2O(1),该反应速率v正=k正•c4(NH3)•c6(NO),v逆=K逆•c5(N2),若将9molNH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)-9•s-1,当平衡时NH3转化率为
5N2(g)+6H2O(1),该反应速率v正=k正•c4(NH3)•c6(NO),v逆=K逆•c5(N2),若将9molNH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)-9•s-1,当平衡时NH3转化率为 ,v逆=
,v逆=___________ mol•L-1•s-1。
(1)已知:①N2(g)+O2(g)
②C(s)+O2(g)=CO2(g) △H2=-393kJ•mol-1
③2C(s)+O2(g)=2CO(g) △H3=-221kJ•mol-1
若某反应的平衡常数表达式为
(2)欲研究在某催化剂作用下2CO(g)+2NO(g)

(3)设
(4)用NH3可以消除NO污染:4NH3(g)+6NO(g)
22-23高二上·江西南昌·阶段练习
类题推荐
接触法制硫酸生产中的关键工序是SO2的催化氧化:2SO2(g)+O2(g) 2SO3(g)。回答下列问题:
2SO3(g)。回答下列问题:
(1)已知相关物质的标准生成焓△fH (由压强为100kPa,温度298K下最稳定单质生成标准状况下1mol物质的热效应或焓变)如表:
(由压强为100kPa,温度298K下最稳定单质生成标准状况下1mol物质的热效应或焓变)如表:
则反应2SO2(g)+O2(g) 2SO3(g) △H=
2SO3(g) △H=______ 。
(2)当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率a随温度的变化如图所示。反应在0.5MPa、550℃时的a=______ 。

(3)设Kpr为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在温度T、初始总压为100kPa的恒容密闭容器中通入2molSO2(g)、1molO2(g)和5molN2,只进行反应:2SO2(g)+O2(g) 2SO3(g),平衡时,测得压强为90kPa,则SO2转化率为
2SO3(g),平衡时,测得压强为90kPa,则SO2转化率为______ ,平衡常数Kpr=______ 。若保持温度、体积和n(SO2)、n(O2)不变,增大n(N2)使总压变大,测得SO2平衡转化率不变,解释原因:______ 。
(4)对反应2SO2(g)+O2(g) 2SO3(g)达平衡后,其他条件不变时,为了同时提高反应速率和SO2的平衡转化率,可采取的措施是
2SO3(g)达平衡后,其他条件不变时,为了同时提高反应速率和SO2的平衡转化率,可采取的措施是______ (填字母序号)。
(5)若该反应的净反应速率方程:v=k正c2(SO2)•c(O2)-k逆c2(SO3)(k正、k逆为速率常数,只与温度、催化剂、接触面积有关,与浓度无关)。温度为T1℃时,k正=810k逆,温度为T2℃时,k正=7220k逆,则T1______ T2(填“>”“<”或“=”)。
(1)已知相关物质的标准生成焓△fH
| 物质的化学式 | SO2(g) | O2(g) | SO3(g) |
| 标准生成焓△fH | -297.0 | 0 | -395.7 |
(2)当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率a随温度的变化如图所示。反应在0.5MPa、550℃时的a=

(3)设Kpr为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在温度T、初始总压为100kPa的恒容密闭容器中通入2molSO2(g)、1molO2(g)和5molN2,只进行反应:2SO2(g)+O2(g)
(4)对反应2SO2(g)+O2(g)
| A.使用高效催化剂 | B.升高温度 |
| C.缩小反应容器的体积 | D.增大SO2的物质的量 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网