解答题-原理综合题 困难0.15 引用1 组卷582
含氮污染物的有效去除和资源的充分利用是重要研究课题,回答下列问题:
(1)利用工业尾气NO2与O3反应制备新型硝化剂N2O5,过程涉及以下反应:
Ⅰ.2O3(g)=3O2(g)△H1 平衡常数为K1
Ⅱ.4NO2(g)+O2(g)=2N2O5(g)△H2 平衡常数为K2
Ⅲ.2NO2(g)+O3(g)=N2O5(g)+O2(g)△H3平衡常数为K3
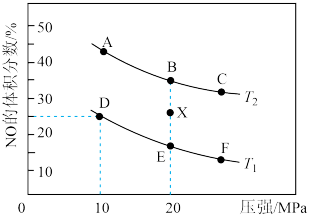
平衡常数K与温度T的函数关系为 、
、 、
、 ,其中x、y、z为常数。
,其中x、y、z为常数。
①K1=________ (用含K2、K3的等式表示)。
②反应△H2________ 0 (填>或<),反应Ⅰ________ (填“高温“、“低温”或“任意温度”)下能自发进行。
③平衡常数与温度的函数关系式和②中一致,则 的取值范围是
的取值范围是________ 。(填序号)
A.<-2 B.-2~0 C.0~2 D.>2
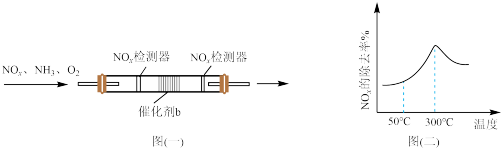
(2)NH3与O2作用分别生成N2、NO和N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去,将一定比例的NH3和N2的混合气体以一定的流速通过装有催化剂的反应管,NH3的转化率、N2的选择性 与温度的关系如图所示。
与温度的关系如图所示。
①其他条件不变,在175~300℃范围内升高温度,出口处氮氧化合物的含量____ (填“增大”或“减小“)。
②综合上述信息,需研发________ (填“高温“或“低温“)下N2选择性和催化效果更高的催化剂,能更有效除去尾气中的NH3。
(3)在催化剂条件下发生反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)可消除NO和CO对环境的污染。为探究温度对该反应的影响,实验初始体系中气体分压p(CO)=p(NO)且p(CO2)=2p(N2),测得反应体系中CO和N2的分压随时间变化情况如表所示。
200℃时,该反应的化学平衡常数Kp=_______ (kPa)-1[Kp表示平衡常数计算表达式中用分压代替浓度计算所得的值],该反应的△H_________ 0(填“>“或“<“)。
(1)利用工业尾气NO2与O3反应制备新型硝化剂N2O5,过程涉及以下反应:
Ⅰ.2O3(g)=3O2(g)△H1 平衡常数为K1
Ⅱ.4NO2(g)+O2(g)=2N2O5(g)△H2 平衡常数为K2
Ⅲ.2NO2(g)+O3(g)=N2O5(g)+O2(g)△H3平衡常数为K3
平衡常数K与温度T的函数关系为
①K1=
②反应△H2
③平衡常数与温度的函数关系式和②中一致,则
A.<-2 B.-2~0 C.0~2 D.>2
(2)NH3与O2作用分别生成N2、NO和N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去,将一定比例的NH3和N2的混合气体以一定的流速通过装有催化剂的反应管,NH3的转化率、N2的选择性

①其他条件不变,在175~300℃范围内升高温度,出口处氮氧化合物的含量
②综合上述信息,需研发
(3)在催化剂条件下发生反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)可消除NO和CO对环境的污染。为探究温度对该反应的影响,实验初始体系中气体分压p(CO)=p(NO)且p(CO2)=2p(N2),测得反应体系中CO和N2的分压随时间变化情况如表所示。
| 时间/min | 0 | 30 | 60 | 120 | 180 | |
| 200℃ | CO的分压/kPa | 4 | 8.8 | 13 | 20 | 20 |
| N2的分压/kPa | 48 | 45.6 | 43.5 | 40 | 40 | |
| 300℃ | CO的分压/kPa | 100 | 69.0 | 48 | 48 | 48 |
| N2的分压/kPa | 10 | 25.5 | 36 | 36 | 36 | |
22-23高二上·重庆九龙坡·期中
类题推荐
含氮污染物的有效去除和资源的充分利用是重要研究课题,回答下列问题:
(1)利用工业尾气 与
与 反应制备新型硝化剂
反应制备新型硝化剂 ,过程中涉及以下反应:
,过程中涉及以下反应:
Ⅰ.
 平衡常数
平衡常数
Ⅱ.
 平衡常数
平衡常数
Ⅲ.
 平衡常数
平衡常数
平衡常数K与温度T的函数关系为 ,
, ,
, ,其中x,y、z为常数,则反应I的活化能Ea(正)
,其中x,y、z为常数,则反应I的活化能Ea(正)_______ Ea(逆)(填“>”或“<”), 的数值范围是
的数值范围是_______ 。
A.<-2 B.-2~0 C.0~2 D.>2
(2) 与
与 作用分别生成
作用分别生成 、NO、
、NO、 的反应均为放热反应。工业尾气中的
的反应均为放热反应。工业尾气中的 可通过催化氧化为
可通过催化氧化为 的选择性
的选择性 与温度的关系如图所示。
与温度的关系如图所示。_______ (填“增大”或“减小”), 的平衡转化率
的平衡转化率_______ (填“增大”或“减小”)。
②根据上图的实验结果可知,需研发_______ (填“高温”或“低温”)下 的选择性更高的催化剂,能更有效除去尾气中的
的选择性更高的催化剂,能更有效除去尾气中的 。
。
(3)在催化剂条件下发生反应: 可消除NO和CO对环境的污染。为探究温度对该反应的影响,实验初始时体系中气体分压
可消除NO和CO对环境的污染。为探究温度对该反应的影响,实验初始时体系中气体分压 且
且 ,测得反应体系中CO和
,测得反应体系中CO和 的分压随时间变化情况如表所示。
的分压随时间变化情况如表所示。
该反应的
_______ 0(填“>”或“<”),物质a为_______ (填“CO”或“ ”),200℃该反应的化学平衡常数
”),200℃该反应的化学平衡常数
_______  。
。
(4)利用电化学原理,将 、
、 和熔融
和熔融 制成燃料电池,模拟工业电解法来精炼银,装置如下图所示。
制成燃料电池,模拟工业电解法来精炼银,装置如下图所示。
效率。法拉第常数
①甲池工作时, 转变成绿色硝化剂
转变成绿色硝化剂 ,可循环使用,则石墨Ⅲ附近发生的电极反应式为
,可循环使用,则石墨Ⅲ附近发生的电极反应式为_______ 。
②若用10A的电流电解60min后,乙中阴极得到38.88gAg,则该电解池的电解效率为_______ %
(1)利用工业尾气
Ⅰ.
Ⅱ.
Ⅲ.
平衡常数K与温度T的函数关系为
A.<-2 B.-2~0 C.0~2 D.>2
(2)

②根据上图的实验结果可知,需研发
(3)在催化剂条件下发生反应:
| 时间/min | 0 | 30 | 60 | 120 | 180 | |
| 200℃ | 物质a的分压/kPa | 4 | 8.8 | 13 | 20 | 20 |
| 物质b的分压/kPa | 48 | 45.6 | 43.5 | 40 | 40 | |
| 300℃ | 物质a的分压/kPa | 100 | 69.0 | 48 | 48 | 48 |
| 物质b的分压/kPa | 10 | 25.5 | 36 | 36 | 36 | |
(4)利用电化学原理,将
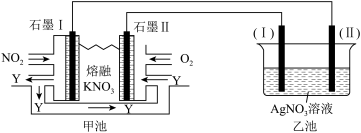
效率。法拉第常数
①甲池工作时,
②若用10A的电流电解60min后,乙中阴极得到38.88gAg,则该电解池的电解效率为
从衣食住行到探索浩瀚宇宙,都有氮及其化合物的参与,但同时有毒含氮化合物的排放,也对环境产生污染。如何实现环境保护与资源利用的和谐统一,已成为我们的重要研究课题。回答下列问题:
(1)在25℃,101 kPa时,利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:
ⅰ.

ⅱ.

ⅲ.

根据信息,写出NO(g)与NH3(g)反应生成N2(g)和H2O(l)的热化学方程式:__________ ;该反应自发进行的条件是__________ (填“高温”或“低温”)。
(2)活性炭还原法是消除氮氧化物污染的有效方法。在三个反应器中分别加入C、CaO/C、La2O3/C,通入NO使其浓度达到0.1 mol/L,不同温度下,测得反应2小时NO去除率如图所示:__________ (填“C”“ CaO/C”或“La2O3/C”),该情况下,A点__________ (填“是”或“不是”)平衡点。
②400℃时,CaO/C催化下反应速率v(NO)=__________ mol/(L·h)。
(3)臭氧脱硝存在如下两个反应:
a. ;
;
b. 。
。
T℃时,将2 mol NO2和1 mol O3混合气体充入一个1 L恒容密闭容器中发生上述反应,测得NO2的物质的量浓度随时间变化关系如下表:
若起始压强为p0,T℃下反应达到平衡时,N2O4的分压与N2O5的分压相等,则O3的体积分数=__________ (保留两位有效数字),反应b平衡常数Kp=__________ (用含p0式子表示,Kp为用平衡分压表示的平衡常数,即用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
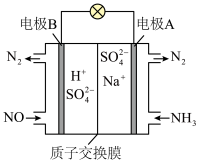
(4)工业上还可以利用原电池原理处理氮氧化合物,工作原理如图所示,则正极的电极反应式为__________ 。
(1)在25℃,101 kPa时,利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:
ⅰ.
ⅱ.
ⅲ.
根据信息,写出NO(g)与NH3(g)反应生成N2(g)和H2O(l)的热化学方程式:
(2)活性炭还原法是消除氮氧化物污染的有效方法。在三个反应器中分别加入C、CaO/C、La2O3/C,通入NO使其浓度达到0.1 mol/L,不同温度下,测得反应2小时NO去除率如图所示:

②400℃时,CaO/C催化下反应速率v(NO)=
(3)臭氧脱硝存在如下两个反应:
a.
b.
T℃时,将2 mol NO2和1 mol O3混合气体充入一个1 L恒容密闭容器中发生上述反应,测得NO2的物质的量浓度随时间变化关系如下表:
| t/h | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| c(NO2)/(mol/L) | 2.0 | 1.4 | 1.0 | 0.70 | 0.50 | 0.40 | 0.40 |
(4)工业上还可以利用原电池原理处理氮氧化合物,工作原理如图所示,则正极的电极反应式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网