解答题-原理综合题 较难0.4 引用1 组卷148
二氧化碳催化还原为乙醇等燃料是解决能源危机和温室效应的一种可持续方法,这有利于实现“碳达峰”和“碳中和”的目标。回答下列问题:
(1)已知:①

②

则

___________ (用 、
、 表示)。
表示)。
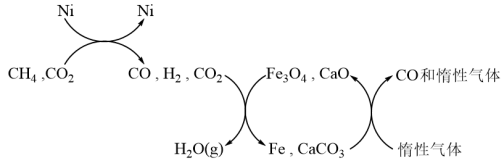
(2)电催化制取乙醇的原理如图所示。
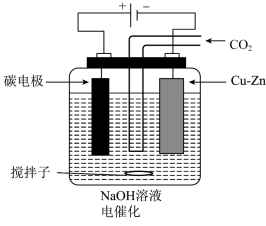
①电催化时,向阴极迁移的主要离子是___________ ,阴极反应式为___________ 。
②标准状况下, 参与反应时,转移的电子数为
参与反应时,转移的电子数为___________ (用 表示)。
表示)。
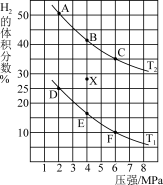
(3) 催化加氢制取乙醇的反应原理为
催化加氢制取乙醇的反应原理为 ,实验测得当起始投料比
,实验测得当起始投料比 为3,气体总压强维持为5MPa时,各物质的平衡组成随温度变化的关系如图所示。
为3,气体总压强维持为5MPa时,各物质的平衡组成随温度变化的关系如图所示。
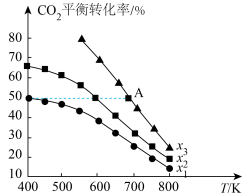
①该反应能自发进行的条件是___________ (填“高温”、“低温”或“任意温度”)。
②A点处, 的平衡转化率为
的平衡转化率为___________ 。
③B点处,乙醇的平衡分压
___________ MPa;对应温度下反应的
___________ (保留3位小数; 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
(1)已知:①
②
则
(2)电催化制取乙醇的原理如图所示。

①电催化时,向阴极迁移的主要离子是
②标准状况下,
(3)

①该反应能自发进行的条件是
②A点处,
③B点处,乙醇的平衡分压
2023·陕西商洛·模拟预测
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网