解答题-实验探究题 适中0.65 引用2 组卷295
环己酮是重要化工原料,是制造尼龙的主要中间体,也是重要的工业溶剂,实验室利用如下反应原理和实验装置制备环己酮(夹持、加热装置略,C1、C2处有仪器未画出):
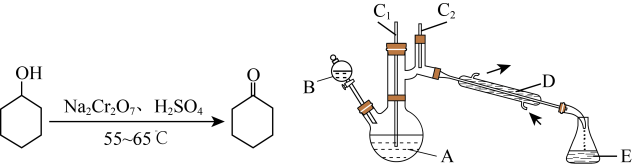
环己醇、环己酮和饱和食盐水的部分物理性质见表(括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点)
实验步骤:
Ⅰ.实验中通过装置B将酸性Na2Cr2O7溶液分批滴加到盛有30mL环己醇的A中,加入第一批Na2Cr2O7溶液后,待反应物的橙红色消失后再加入第二批……依次进行下去,直至反应结束,控制反应在55~65℃进行。反应结束后,向反应液中加入适量的草酸。
Ⅱ.反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
Ⅲ.进一步分离提纯得到精环已酮18.0g。
(1)实验装置图中C1处应放置的仪器名称为_______ 。
(2)A中发生反应的离子方程式为_______ ,用蒸馏不能分离环己酮和水的原因是_______ 。
(3)实验过程中Na2Cr2O7溶液分批加入的原因是_______ 。
(4)步骤Ⅰ加入适量草酸为了将剩余的Na2Cr2O7完全反应,草酸与Na2Cr2O7的物质的量之比为_______ 时反应恰好进行完全。
(5)环己酮的提纯需要经过以下一系列的操作:a.蒸馏,收集151-156℃馏分,得到精品b.过滤c.在收集到的粗品中加NaCl固体至饱和,静置,分液d.加入无水MgSO4固体,除去有机物中少量水。上述操作的正确顺序是_______ (填序号)。上述操作c中,加入NaCl固体的作用是_______ 。
(6)计算环己酮的产率_______ 。(保留整数)

环己醇、环己酮和饱和食盐水的部分物理性质见表(括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点)
| 物质 | 密度/(g/cm3) | 沸点/℃ | 部分性质 |
| 环己醇 | 0.90 | 161.1(97.8) | 能溶于水,具有还原性,易被氧化 |
| 环己酮 | 0.88 | 155.6(95) | 微溶于水,遇氧化剂易发生开环反应 |
| 饱和食盐水 | 1.33 | 108.0 |
Ⅰ.实验中通过装置B将酸性Na2Cr2O7溶液分批滴加到盛有30mL环己醇的A中,加入第一批Na2Cr2O7溶液后,待反应物的橙红色消失后再加入第二批……依次进行下去,直至反应结束,控制反应在55~65℃进行。反应结束后,向反应液中加入适量的草酸。
Ⅱ.反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
Ⅲ.进一步分离提纯得到精环已酮18.0g。
(1)实验装置图中C1处应放置的仪器名称为
(2)A中发生反应的离子方程式为
(3)实验过程中Na2Cr2O7溶液分批加入的原因是
(4)步骤Ⅰ加入适量草酸为了将剩余的Na2Cr2O7完全反应,草酸与Na2Cr2O7的物质的量之比为
(5)环己酮的提纯需要经过以下一系列的操作:a.蒸馏,收集151-156℃馏分,得到精品b.过滤c.在收集到的粗品中加NaCl固体至饱和,静置,分液d.加入无水MgSO4固体,除去有机物中少量水。上述操作的正确顺序是
(6)计算环己酮的产率
2023·陕西西安·模拟预测
类题推荐
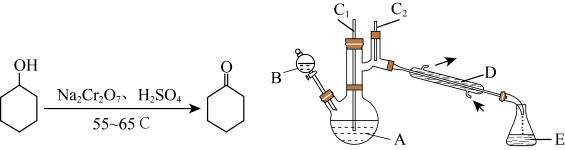
环己酮是重要的化工原料,是制造尼龙的主要中间体,也是重要的工业溶剂,实验室利用如下反应原理和实验装置(部分夹持装置略去)制备环己酮:
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中在55~65℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称是___________ ,该制备过程采用的加热方式为___________ 。
(2)A中发生反应的离子方程式为___________ 。(已知: 会生成Cr3+)
会生成Cr3+)
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是___________ 。
②d中往液体中加入NaCl固体的目的是___________ 。
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有___________ 。
④a操作中加入碎瓷片的作用是___________ 。
| 物质 | 沸点/℃ | 密度( | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
| 环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
| 水 | 100.0 | 1.0 | - |
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中在55~65℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称是
(2)A中发生反应的离子方程式为
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是
②d中往液体中加入NaCl固体的目的是
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有
④a操作中加入碎瓷片的作用是
环己酮是重要的化工原料,是制造尼龙的主要中间体,也是重要的工业溶剂,实验室利用如下反应原理和实验装置(部分夹持装置略去)制备环己酮:

有关物质的物理性质见下表。
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中在55~65℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称是___________ ;该制备过程采用的加热方式为___________ 。
(2)A中发生反应的离子方程式为___________ 。(已知: 会生成
会生成 )
)
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是___________ ;
②d中往液体中加入NaCl固体的目的是___________ ;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有___________ 。
④a操作中加热后发现忘记加入碎瓷片,应___________ 。

有关物质的物理性质见下表。
| 物质 | 沸点/℃ | 溶解性 | |
| 环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
| 环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
| 水 | 100.0 | 1.0 | - |
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中在55~65℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称是
(2)A中发生反应的离子方程式为
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是
②d中往液体中加入NaCl固体的目的是
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有
④a操作中加热后发现忘记加入碎瓷片,应
环己酮是重要化工原料,是制造尼龙的主要中间体,也是重要的工业溶剂,实验室利用如下反应原理和实验装置(部分夹持装置略去)制备环己酮:

有关物质的物理性质见表。
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的的名称是为_____ 。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致系体温度迅速上升,副反应增多。简述滴加酸性Na2Cr2O7溶液的方法_____ ;A中发生反应的离子方程式为_____ 。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是_____ ;
②d中往液体中加入NaCl固体的目的是_____ ;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有_____ 。
(4)恢复至室温时,分离得到纯产品体积为8rnL,则环己酮的产率为_____ (保留三个有效数字)。

有关物质的物理性质见表。
| 物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
| 环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
| 水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的的名称是为
(2)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致系体温度迅速上升,副反应增多。简述滴加酸性Na2Cr2O7溶液的方法
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是
②d中往液体中加入NaCl固体的目的是
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有
(4)恢复至室温时,分离得到纯产品体积为8rnL,则环己酮的产率为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


