解答题-原理综合题 适中0.65 引用1 组卷200
工业合成氨是人工固氮研究的重要领域,回答下列问题:
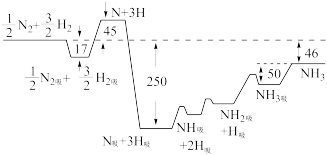
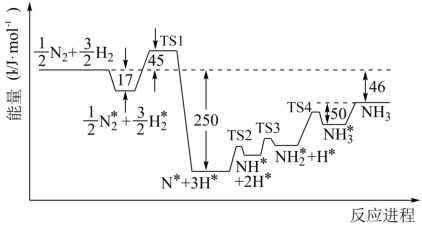
(1)诺贝尔化学奖获得者格哈德·埃特尔确认了合成氨反应机理。673K时,各步反应的能量变化如图所示,其中吸附在催化剂表面上的粒子用“*”标注。
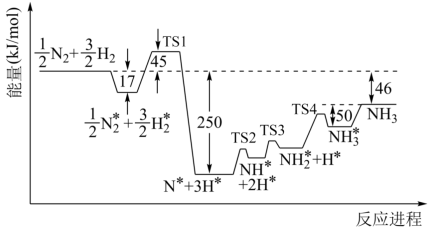
图中决速步骤的反应方程式为___________________ ,该步反应的活化能Ea=______ kJ·mol-1。
(2)相同质量的同种催化剂,在载体上的分散度越高,催化作用越强,原因是_________________ 。
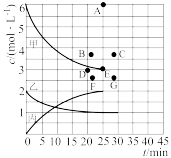
NH3在少量某催化剂下分解的实验数据如下表:
分析表中数据可知,随着反应进行,c( NH3 )减小,平均反应速率____________ (填“增大”、“减小”或“不变”),对该分析结果的合理解释是____________________ 。
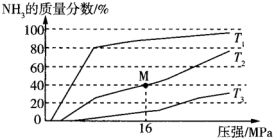
(3)在一定条件下,向某反应容器中投入4 mol N2和10 mol H2在不同温度下反应,平衡体系中氨的物质的量分数随压强变化曲线如图所示:
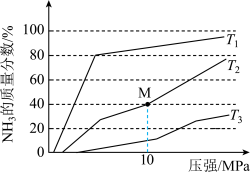
①T1、T2、T3中温度最高的是______ ,M点N2的转化率为_________________ 。
②1939年捷姆金和佩热夫推出合成氨反应在接近平衡时净速率方程式为:v(NH3) =k1p(N2) ,k1、k2的分别为正反应和逆反应的速率常数;p(N2)、p(H2)、p(NH3)代表各组分的分压;α为常数。工业上以铁为催化剂,α=0.5,由M点数据计算
,k1、k2的分别为正反应和逆反应的速率常数;p(N2)、p(H2)、p(NH3)代表各组分的分压;α为常数。工业上以铁为催化剂,α=0.5,由M点数据计算 =
=___________ (MPa) -2。
(1)诺贝尔化学奖获得者格哈德·埃特尔确认了合成氨反应机理。673K时,各步反应的能量变化如图所示,其中吸附在催化剂表面上的粒子用“*”标注。

图中决速步骤的反应方程式为
(2)相同质量的同种催化剂,在载体上的分散度越高,催化作用越强,原因是
NH3在少量某催化剂下分解的实验数据如下表:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
c( NH3)/mol·L-1 | c0 | 0.9 c0 | 0.8 c0 | 0.7 c0 | 0.6 c0 | 0. 5 c0 |
(3)在一定条件下,向某反应容器中投入4 mol N2和10 mol H2在不同温度下反应,平衡体系中氨的物质的量分数随压强变化曲线如图所示:

①T1、T2、T3中温度最高的是
②1939年捷姆金和佩热夫推出合成氨反应在接近平衡时净速率方程式为:v(NH3) =k1p(N2)
2023·黑龙江哈尔滨·模拟预测
类题推荐
工业合成氨是人工固氮研究的重要领域,回答下列问题:
(1)诺贝尔化学奖获得者格哈德·埃特尔确认了合成氨反应机理。 时,各步反应的能量变化如图所示,其中吸附在催化剂表面上的粒子用“*”标注。
时,各步反应的能量变化如图所示,其中吸附在催化剂表面上的粒子用“*”标注。___________ ,该步反应的活化能
___________  。
。
(2)关于合成氨工艺的下列理解,正确的是___________ 。
A.合成氨的反应在较低温度下可为自发反应
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气( 和
和 的比例不变)中添加少量惰性气体,有利于提高平衡转化率
的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于 有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
E.分离空气可得 ,通过天然气和水蒸气转化可得
,通过天然气和水蒸气转化可得 ,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
(3)①相同质量的同种催化剂,在载体上的分散度越高,催化作用越强,原因是___________ 。
②已知 在催化剂表面的吸附量会影响催化效果,
在催化剂表面的吸附量会影响催化效果, 在少量某催化剂下分解的实验数据如下表:
在少量某催化剂下分解的实验数据如下表:
分析表中数据可知,随着反应进行, 减小,平均反应速率
减小,平均反应速率___________ (填“增大”、“减小”或“不变”),对该分析结果的合理解释是___________ 。
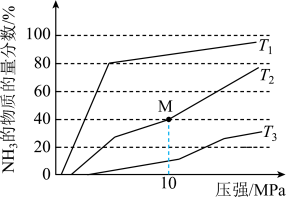
(4)在一定条件下,向某反应容器中投入 和
和 在不同温度下反应,平衡体系中氨的物质的量分数随压强变化曲线如图所示:
在不同温度下反应,平衡体系中氨的物质的量分数随压强变化曲线如图所示: 中温度最高的是
中温度最高的是___________ ,M点 的转化率为
的转化率为___________ 。
②1939年捷姆金和佩热夫推出合成氨反应在接近平衡时净速率方程式为: 的分别为正反应和逆反应的速率常数;
的分别为正反应和逆反应的速率常数; 代表各组分的分压;α为常数,当达平衡时,净速率为0,工业上以铁为催化剂,
代表各组分的分压;α为常数,当达平衡时,净速率为0,工业上以铁为催化剂, ,由M点数据计算
,由M点数据计算
___________  。
。
(1)诺贝尔化学奖获得者格哈德·埃特尔确认了合成氨反应机理。
(2)关于合成氨工艺的下列理解,正确的是
A.合成氨的反应在较低温度下可为自发反应
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(
D.基于
E.分离空气可得
(3)①相同质量的同种催化剂,在载体上的分散度越高,催化作用越强,原因是
②已知
| 反应时间/ | 0 | 10 | 20 | 30 | 40 | 50 |
(4)在一定条件下,向某反应容器中投入
②1939年捷姆金和佩热夫推出合成氨反应在接近平衡时净速率方程式为:
氨是重要的化工产品,实现温和条件下氨的高效合成一直是催化领域的重要研究课题。
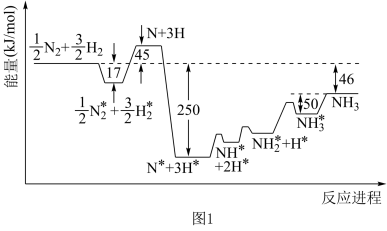
(1)诺贝尔化学奖获得者格哈德·埃特尔确认了合成氨反应机理。673 K时,各步反应的能量变化如图1所示,其中吸附在催化剂表面上的物种用“*”标注。图1中决速步骤反应的活化能Ea=___________ kJ/mol,写出合成氨反应的热化学方程式为___________ 。
(2)①在一定条件下,向某反应容器中投入5 mol N2、15 mol H2在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图2所示:
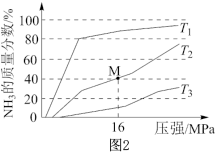
温度T1、T2、T3中,最大的是___________ ,M点N2的转化率为___________ ;
②1939年捷姆金和佩热夫推出氨合成反应在接近平衡时净速率方程式为: ,k1、k2分别为正反应和逆反应的速率常数;p(N2)、p(H2)、p(NH3)代表各组分的分压(分压=总压×物质的量分数);α为常数,工业上以铁为催化剂时,α=0.5。由M点数据计算
,k1、k2分别为正反应和逆反应的速率常数;p(N2)、p(H2)、p(NH3)代表各组分的分压(分压=总压×物质的量分数);α为常数,工业上以铁为催化剂时,α=0.5。由M点数据计算
___________ MPa2(保留两位小数)。
(3)硼簇修饰碳纳米管原位负载的纳米金表面电催化合成氨的反应机理如图3。下列说法正确的是___________

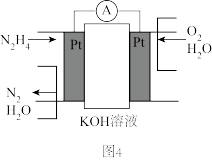
(4)纳米金表面电催化合成NH3的过程中,有副产物N2H4生成,N2H4是一种高能燃料,可用于燃料电池,原理如图4,N2H4的电子式为___________ ,电池的负极反应式为___________ 。
(1)诺贝尔化学奖获得者格哈德·埃特尔确认了合成氨反应机理。673 K时,各步反应的能量变化如图1所示,其中吸附在催化剂表面上的物种用“*”标注。图1中决速步骤反应的活化能Ea=

(2)①在一定条件下,向某反应容器中投入5 mol N2、15 mol H2在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图2所示:

温度T1、T2、T3中,最大的是
②1939年捷姆金和佩热夫推出氨合成反应在接近平衡时净速率方程式为:
(3)硼簇修饰碳纳米管原位负载的纳米金表面电催化合成氨的反应机理如图3。下列说法正确的是___________

| A.上述转化过程中涉及非极性键、离子键的断裂和极性键的生成 |
| B.生成NH3的电极总反应式为N2+6H++6e-=2NH3 |
| C.使用纳米金作催化剂可以降低反应的活化能,从而提高化学反应速率 |
| D.当标准状况下22.4 LN2发生反应时,可得到2 mol NH3 |

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网