解答题-实验探究题 适中0.65 引用1 组卷36
研究硫及其化合物的应用价值对于社会发展意义重大。请回答以下问题:
(1)欲制备Na2S2O3,从氧化还原角度分析,下列方法合理的是___________(选填字母序号)。
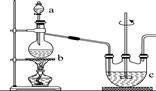
(2)用下图所示装置制备纯净的SO2(同时生成一种正盐),请写出发生装置中反应的化学方程式为___________ ,碱石灰的主要作用为___________ 。
(3)工业上回收利用SO2的一种途径是: 。
。
①写出少量SO2通入氨水发生的离子方程式___________ 。
②某实验小组为测定步骤2溶液中(NH4)2SO3的氧化率α,设计了以下实验方案。[提示:氧化率 ]
]
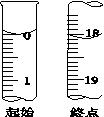
【方案一】一定条件下向100mL1mol∙L-的(NH4)2SO3溶液中通入空气后,先加入足量的稀盐酸,充分反应后,再加入足量BaCl2溶液,过滤、洗涤、烘干,得到沉淀18.64g。
I.计算(NH4)2SO3的氧化率α=___________ (用百分数表示)。
【方案二】一定条件下向100mLc0 mol∙L-1的(NH4)2SO3溶液中通入空气后,取20.00mL反应后的溶液于锥形瓶中,用浓度为c mol∙L-1的KMnO4标准溶液(经H2SO4酸化)滴定,滴定过程中锰元素被还原成Mn2+。重复操作三次,恰好完全反应时平均消耗KMnO4溶液的体积是Vml。
Ⅱ.写出滴定反应的离子方程式___________ 。
(1)欲制备Na2S2O3,从氧化还原角度分析,下列方法合理的是___________(选填字母序号)。
| A.Na2S+S | B.Na2SO3+S | C.Na2SO3+H2SO4 | D.SO2+Na2SO3 |

(3)工业上回收利用SO2的一种途径是:
①写出少量SO2通入氨水发生的离子方程式
②某实验小组为测定步骤2溶液中(NH4)2SO3的氧化率α,设计了以下实验方案。[提示:氧化率
【方案一】一定条件下向100mL1mol∙L-的(NH4)2SO3溶液中通入空气后,先加入足量的稀盐酸,充分反应后,再加入足量BaCl2溶液,过滤、洗涤、烘干,得到沉淀18.64g。
I.计算(NH4)2SO3的氧化率α=
【方案二】一定条件下向100mLc0 mol∙L-1的(NH4)2SO3溶液中通入空气后,取20.00mL反应后的溶液于锥形瓶中,用浓度为c mol∙L-1的KMnO4标准溶液(经H2SO4酸化)滴定,滴定过程中锰元素被还原成Mn2+。重复操作三次,恰好完全反应时平均消耗KMnO4溶液的体积是Vml。
Ⅱ.写出滴定反应的离子方程式
22-23高一下·陕西安康·期中
类题推荐
SO2的污染防治与利用对于环境保护意义重大。某化学小组在实验室中对SO2的制备、性质及回收利用等相关问题进行探究。请回答下列问题:
(1)制备并收集纯净的SO2

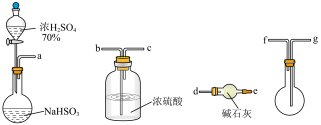
①用上图装置制备纯净的SO2,发生装置中反应的化学方程式为_______ 。
②装置的连接顺序为:a→_______ (按气流方向,用字母标号表示)。
(2)设计实验探究SO2中+4价S的性质
限选试剂:NaOH溶液、稀H2SO4、H2O2溶液、FeCl3溶液、淀粉KI溶液、新制H2S溶液
填写表格中相应内容:
①_______ ; ②_______ ;③_______ ; ④_______ 。
(3)设计回收利用SO2的途径: 。该小组欲测定步骤II中(NH4)2SO3的转化率(α),设计如下实验方案:一定条件下,向100mLcmol/L的(NH4)2SO3溶液中通入空气,向反应后的溶液中加入过量的盐酸,再加入足量的氯化钡溶液,生成沉淀,将沉淀过滤、洗涤、干燥、称量,质量为mg。
。该小组欲测定步骤II中(NH4)2SO3的转化率(α),设计如下实验方案:一定条件下,向100mLcmol/L的(NH4)2SO3溶液中通入空气,向反应后的溶液中加入过量的盐酸,再加入足量的氯化钡溶液,生成沉淀,将沉淀过滤、洗涤、干燥、称量,质量为mg。
①检验沉淀是否洗净的方法是_______ 。
②α=_______ ×100%(用含c、m的代数式表示)。

(1)制备并收集纯净的SO2

①用上图装置制备纯净的SO2,发生装置中反应的化学方程式为
②装置的连接顺序为:a→
(2)设计实验探究SO2中+4价S的性质
限选试剂:NaOH溶液、稀H2SO4、H2O2溶液、FeCl3溶液、淀粉KI溶液、新制H2S溶液
| 实验操作 | 实验现象 | 实验结论 | |
| 实验一 | 将SO2通入新制H2S溶液中 | 溶液变浑浊 | SO2中+4价S具有________性 |
| 实验二 | 将SO2通入_________中 | ________ | SO2中+4价S具有还原性,反应的离子方程式为_______ |
①
(3)设计回收利用SO2的途径:
①检验沉淀是否洗净的方法是
②α=
请回答下列问题:
(1)已知部分弱酸的电离平衡常数如下表:
①相同条件下,0.1mol·L-1下列溶液中,c( )由大到小的排列顺序是
)由大到小的排列顺序是_______ (填标号)。
A.(NH4)2SO4 B.(NH4)2CO3 C. NH4 Cl D.NH4HSO4 E.NH3·H2O
②下列离子方程式正确的是_______ (填标号)。
A.NaClO溶液中通入少量CO2:CO2+H2O+2ClO-= +2HClO
+2HClO
B.Ca(ClO)2溶液中通入少量SO2:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.Na2CO3溶液中滴加少量氯水:2 +Cl2+H2O=Cl-+ClO-+2
+Cl2+H2O=Cl-+ClO-+2
D.Na2S溶液中通入过量SO2:S2-+2SO2+2H2O=2 +H2S↑
+H2S↑
(2)锅炉中最难清洗的锅垢是硫酸钡固体,298K时工业上常使用碳酸钠溶液进行处理:BaSO4(s)+ (aq)
(aq) BaCO3(s)+
BaCO3(s)+ (aq) K(298K)=0.1,需要处理0.1molBaSO4,加入1L Na2CO3溶液,碳酸钠的物质的量浓度是
(aq) K(298K)=0.1,需要处理0.1molBaSO4,加入1L Na2CO3溶液,碳酸钠的物质的量浓度是_______ mol·L-1(不考虑溶液体积变化)。
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式:_______ 。
②盐酸肼水溶液中离子浓度的关系正确的_______ (填标号)。
A.c(Cl-)>c(N2H )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O]+)>c(H+)>c(OH-)
C.2c(N2H )+c([N2H5·H2O]+)+c(H+)=c(Cl-)+c(OH-)
)+c([N2H5·H2O]+)+c(H+)=c(Cl-)+c(OH-)
D.c(N2H )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)
(4)硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:
①准确称取1.7700 g样品,配制成100.00mL溶液A;
②准确量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825 g;
③准确量取25.00 mL溶液A,加适量稀硫酸酸化后,用0.020 00 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。
H2O2与KMnO4反应的离子方程式如下:2 +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①上述滴定若不加稀硫酸酸化, 被还原为MnO2,其离子方程式为
被还原为MnO2,其离子方程式为_______ 。
②通过计算确定样品的组成(写出计算过程)_______ 。
(1)已知部分弱酸的电离平衡常数如下表:
| 弱酸 | H2S | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka1=1.1×10-7 Ka2=1.3×10-13 | Ka1=4.0×10-8 | Ka1=4.5×10-7 Ka2=4.7×10-11 | Ka1=1.4×10-2 Ka2=6.0×10-8 |
①相同条件下,0.1mol·L-1下列溶液中,c(
A.(NH4)2SO4 B.(NH4)2CO3 C. NH4 Cl D.NH4HSO4 E.NH3·H2O
②下列离子方程式正确的是
A.NaClO溶液中通入少量CO2:CO2+H2O+2ClO-=
B.Ca(ClO)2溶液中通入少量SO2:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.Na2CO3溶液中滴加少量氯水:2
D.Na2S溶液中通入过量SO2:S2-+2SO2+2H2O=2
(2)锅炉中最难清洗的锅垢是硫酸钡固体,298K时工业上常使用碳酸钠溶液进行处理:BaSO4(s)+
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式:
②盐酸肼水溶液中离子浓度的关系正确的
A.c(Cl-)>c(N2H
B.c(Cl-)>c([N2H5·H2O]+)>c(H+)>c(OH-)
C.2c(N2H
D.c(N2H
(4)硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:
①准确称取1.7700 g样品,配制成100.00mL溶液A;
②准确量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825 g;
③准确量取25.00 mL溶液A,加适量稀硫酸酸化后,用0.020 00 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。
H2O2与KMnO4反应的离子方程式如下:2
①上述滴定若不加稀硫酸酸化,
②通过计算确定样品的组成(写出计算过程)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网