解答题-实验探究题 较难0.4 引用1 组卷205
氯气是一种重要的化工原料,在生产生活中有着重要的应用。
(1)某研究小组探究氯气和氯水的漂白性,用浓盐酸与MnO2反应制备氯气,其化学反应方程式为_______ 。生成的氯气通入如图装置,所需装置的接口连接顺序为_______ (填字母序号)。

证明氯水具有漂白性是由于Cl2与H2O反应生成了具有漂白性的物质的实验现象是_______ 。
(2)在用浓盐酸与MnO2混合加热制氯气过程中,发现氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。关于MnO2剩余的原因,该小组提出如下猜想:
猜想ⅰ:随着反应进行,c(H+)降低,Cl-的还原性减弱,不能还原MnO2。
猜想ⅱ:随着反应进行,c(H+)降低,MnO2的氧化性减弱,不能氧化Cl-。
猜想ⅱi:随着反应进行,c(Cl-)降低,Cl-的还原性减弱,不能还原MnO2。
猜想iv:随着反应进行,c(Mn2+)升高,MnO2的氧化性减弱,不能氧化Cl-。
该小组设计原电池装置验证上述猜想,请补充横线部分的内容。(恒温装置未画出)
(1)某研究小组探究氯气和氯水的漂白性,用浓盐酸与MnO2反应制备氯气,其化学反应方程式为

证明氯水具有漂白性是由于Cl2与H2O反应生成了具有漂白性的物质的实验现象是
(2)在用浓盐酸与MnO2混合加热制氯气过程中,发现氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。关于MnO2剩余的原因,该小组提出如下猜想:
猜想ⅰ:随着反应进行,c(H+)降低,Cl-的还原性减弱,不能还原MnO2。
猜想ⅱ:随着反应进行,c(H+)降低,MnO2的氧化性减弱,不能氧化Cl-。
猜想ⅱi:随着反应进行,c(Cl-)降低,Cl-的还原性减弱,不能还原MnO2。
猜想iv:随着反应进行,c(Mn2+)升高,MnO2的氧化性减弱,不能氧化Cl-。
该小组设计原电池装置验证上述猜想,请补充横线部分的内容。(恒温装置未画出)
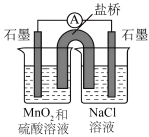 | ||||
| 实验编号 | 实验步骤 | 实验现象 | 实验结论 | 实验反思与评价 |
| i | 向右侧烧杯中滴入几滴浓盐酸 | 猜想i成立 | 该操作不能验证猜想i,理由① | |
| ii | ② | ③ | 猜想ii成立 | 正极的电极反应方程式④ |
| …… | ||||
| iv | 在验证了猜想ii和iii均成立以后,向左侧烧杯中加入⑤ | 电流表几乎无示数 | 猜想iv成立 | |
22-23高三上·广东广州·阶段练习
类题推荐
浓盐酸是一种化学实验室常用的试剂。实验用浓盐酸一般质量分数为37.0%。
(1)用浓盐酸配制100mL浓度为0.100 mol/L的稀盐酸,下列操作错误的有
___________ 。
(2)写出浓盐酸与MnO2混合加热生成MnCl2和Cl2的离子反应方程式
___________ 。
(3)在用浓盐酸与MnO2混合加热制氯气过程中,发现氯气不再逸出时,固液混合物中仍存在盐酸和MnO2。
①关于MnO2剩余的原因,该小组提出如下猜想:
猜想ⅰ.随着反应进行,c(H+)降低,Cl-的还原性减弱,不能被MnO2氧化
猜想ⅱ.随着反应进行,c(H+)降低,MnO2的氧化性减弱,不能氧化Cl-。
猜想ⅱi.随着反应进行,c(Cl-)降低,Cl-的还原性减弱,不能被MnO2氧化。
猜想iv.随着反应进行,c(Mn2+)升高,MnO2的氧化性减弱,不能氧化Cl-。
该小组设计原电池装置验证上述猜想。
(1)用浓盐酸配制100mL浓度为0.100 mol/L的稀盐酸,下列操作错误的有
 |  |  |  |
| A.浓盐酸稀释 | B.上下颠倒摇匀 | C.定容 | D.用蒸馏水洗涤烧杯和玻璃棒 |
| A.A | B.B | C.C | D.D |
(2)写出浓盐酸与MnO2混合加热生成MnCl2和Cl2的离子反应方程式
(3)在用浓盐酸与MnO2混合加热制氯气过程中,发现氯气不再逸出时,固液混合物中仍存在盐酸和MnO2。
①关于MnO2剩余的原因,该小组提出如下猜想:
猜想ⅰ.随着反应进行,c(H+)降低,Cl-的还原性减弱,不能被MnO2氧化
猜想ⅱ.随着反应进行,c(H+)降低,MnO2的氧化性减弱,不能氧化Cl-。
猜想ⅱi.随着反应进行,c(Cl-)降低,Cl-的还原性减弱,不能被MnO2氧化。
猜想iv.随着反应进行,c(Mn2+)升高,MnO2的氧化性减弱,不能氧化Cl-。
该小组设计原电池装置验证上述猜想。
恒温装置未画出。每组实验前都将电池装置放电至无明显现象且电流表归零为止。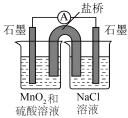 | ||||
| 组别 | 实验步骤 | 实验现象 | 实验结论 | 实验反思与评价 |
| i | 向右侧烧杯中滴入几滴浓盐酸 | 该操作不能验证猜想i,理由是① | ||
| ii | 将实验步骤补充完整:② | 预测现象:③ | 猜想ii成立 | 正极的电极反应方程式为④ |
| …… | ||||
| iv | 在验证了猜想i不成立、猜想ii和iii均成立以后,向左侧烧杯中加入⑤ | 电流表几乎无示数 | 猜想iv成立 | |
某小组用MnO2与浓盐酸混合共热制备氯气。
(1)反应的离子方程式是_______ 。
(2)为净化与收集Cl2,选用下图所示的部分装置进行实验,装置的接口连接顺序为_______ 。
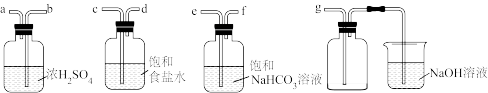
(3)当Cl2不再生成时,反应容器中仍存在MnO2和盐酸,该小组进行以下实验探究。
①实验任务 探究反应后的容器中仍存在MnO2和盐酸,却不再产生Cl2的原因。
②查阅资料 物质氧化性和还原性变化的一般规律是:还原反应中,增大反应物浓度或降低生成物浓度,氧化剂的氧化性增强;氧化反应中,增大反应物浓度或降低生成物浓度,还原剂的还原性增强。
③提出猜想 猜想a:在此反应中,随H+浓度降低,氧化剂_______ (填氧化剂化学式)氧化性减弱。
猜想b:在此反应中,_______ 减弱。
猜想c:在此反应中,随Mn2+浓度升高,氧化剂氧化性减弱。
④设计实验、验证猜想 向反应后的固液混合物中加入试剂,观察并记录有无氯气生成(Na+对各物质的氧化性与还原性均无影响)。请在答题线上完成表中内容。
⑤数据分析,得出结论 猜想a、猜想b和猜想c均正确。
⑥迁移应用 25℃时, 。一般情况下,在金属活动性顺序里,位于氢前面的金属能置换出酸中的氢,资料显示Ag也可以与HI发生置换反应生成H2,依据②中信息,可能的原因是:
。一般情况下,在金属活动性顺序里,位于氢前面的金属能置换出酸中的氢,资料显示Ag也可以与HI发生置换反应生成H2,依据②中信息,可能的原因是:_______ 。
(1)反应的离子方程式是
(2)为净化与收集Cl2,选用下图所示的部分装置进行实验,装置的接口连接顺序为
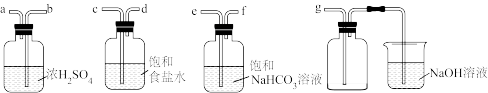
(3)当Cl2不再生成时,反应容器中仍存在MnO2和盐酸,该小组进行以下实验探究。
①实验任务 探究反应后的容器中仍存在MnO2和盐酸,却不再产生Cl2的原因。
②查阅资料 物质氧化性和还原性变化的一般规律是:还原反应中,增大反应物浓度或降低生成物浓度,氧化剂的氧化性增强;氧化反应中,增大反应物浓度或降低生成物浓度,还原剂的还原性增强。
③提出猜想 猜想a:在此反应中,随H+浓度降低,氧化剂
猜想b:在此反应中,
猜想c:在此反应中,随Mn2+浓度升高,氧化剂氧化性减弱。
④设计实验、验证猜想 向反应后的固液混合物中加入试剂,观察并记录有无氯气生成(Na+对各物质的氧化性与还原性均无影响)。请在答题线上完成表中内容。
| 实验序号 | 操作 | 有无氯气生成 |
| 1 | 加入较浓硫酸,使 | 有氯气 |
| 2 | 加入NaCl固体,使 | 有氯气 |
| 3 | 无氯气 |
⑥迁移应用 25℃时,
氯气是一种重要的非金属单质,某小组同学在实验室研究氯气的制备和性质。
第一部分:小组同学用二氧化锰与过量浓盐酸反应制备氯气过程中发现,二氧化锰仍有剩余时就观察到反应停止,该小组同学进行了一系列实验探究二氧化锰仍有剩余时反应停止的原因。
【提出猜想】ⅰ.随着反应进行,c(Cl-)降低,不能被二氧化锰氧化。
ⅱ.随着反应进行,……
【进行实验】将反应后的固液混合物倒出,平均分在两个试管中,分别进行以下实验,证实了猜想i不成立。
(1)请将表中的实验操作和实验现象补充完整。
【进一步实验】设计如图实验进一步探究。
(2)实验Ⅲ中滴加浓硫酸后,左边烧杯中的电极反应式是___ 。
(3)依据实验Ⅰ—Ⅳ,解释“二氧化锰仍有剩余时就观察到反应停止”的原因是___ 。
第二部分:制备SnCl4
SnCl4在工业上常用作媒染剂和有机合成上的氯化催化剂,其熔点是-33℃,沸点是114℃,在常温常压下为无色液体,在潮湿的空气中易水解。该小组同学设计了如图装置制备SnCl4。

回答下列问题:
(4)装置A中反应的化学方程式为___ ,装置F的作用是___ 。
(5)利用该方法制备的SnCl4中含有少量SnCl2杂质,可利用Fe3+与Sn2+反应生成Fe2+与Sn4+,测定产物中SnCl4的质量分数,具体操作如下:取反应后的固体7.600g于试管中,加适量的盐酸溶解,加入少量KSCN溶液做指示剂,用0.1000mol/LFeCl3标准溶液进行滴定,用去FeCl3溶液的体积为20.00mL。
①滴定终点的现象为___ 。
②SnCl4的质量分数是____ (保留四位有效数字)。
第一部分:小组同学用二氧化锰与过量浓盐酸反应制备氯气过程中发现,二氧化锰仍有剩余时就观察到反应停止,该小组同学进行了一系列实验探究二氧化锰仍有剩余时反应停止的原因。
【提出猜想】ⅰ.随着反应进行,c(Cl-)降低,不能被二氧化锰氧化。
ⅱ.随着反应进行,……
【进行实验】将反应后的固液混合物倒出,平均分在两个试管中,分别进行以下实验,证实了猜想i不成立。
(1)请将表中的实验操作和实验现象补充完整。
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 将湿润的淀粉碘化钾试纸放置于试管口,加热试管;① | 试纸未变蓝 |
| Ⅱ | 将湿润的淀粉碘化钾试纸放置于试管口,加热试管;滴入2滴浓硫酸,充分振荡,继续加热 | 滴入浓硫酸前,② |
【进一步实验】设计如图实验进一步探究。
| 序号 | 实验装置 | 实验操作 | 现象 |
| Ⅲ | 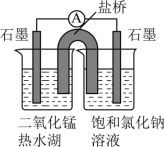 | 向左侧烧杯中滴加2滴浓硫酸 | 滴加浓硫酸前,电流表指针不偏转:滴加浓硫酸后,电流表指针偏转 |
| Ⅳ | 向右侧烧杯中滴加2滴浓硫酸 | 电流表指针始终不偏转 |
(3)依据实验Ⅰ—Ⅳ,解释“二氧化锰仍有剩余时就观察到反应停止”的原因是
第二部分:制备SnCl4
SnCl4在工业上常用作媒染剂和有机合成上的氯化催化剂,其熔点是-33℃,沸点是114℃,在常温常压下为无色液体,在潮湿的空气中易水解。该小组同学设计了如图装置制备SnCl4。

回答下列问题:
(4)装置A中反应的化学方程式为
(5)利用该方法制备的SnCl4中含有少量SnCl2杂质,可利用Fe3+与Sn2+反应生成Fe2+与Sn4+,测定产物中SnCl4的质量分数,具体操作如下:取反应后的固体7.600g于试管中,加适量的盐酸溶解,加入少量KSCN溶液做指示剂,用0.1000mol/LFeCl3标准溶液进行滴定,用去FeCl3溶液的体积为20.00mL。
①滴定终点的现象为
②SnCl4的质量分数是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


