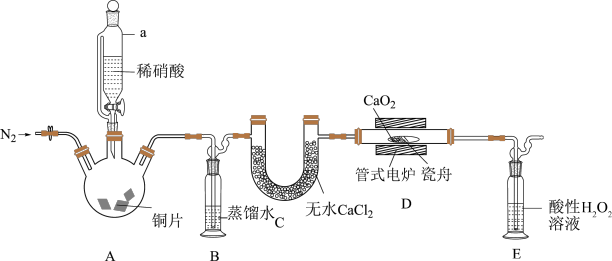解答题-实验探究题 适中0.65 引用1 组卷32
I.某化学兴趣小组探究铁粉与硫酸铜溶液反应时溶液pH变化。
(1)甲同学提出硫酸铜溶液显酸性,理由是_______ (写离子方程式),加入铁粉消耗了 和
和 ,溶液pH会
,溶液pH会_______ (填“增大”、“不变”或“减小”;已知相同条件下, 的水解程度强于
的水解程度强于 )。
)。
Ⅱ.乙同学用pH传感器测铁粉和 溶液反应时溶液pH的变化。
溶液反应时溶液pH的变化。
【实验用品】仪器:pH传感器、笔记本电脑、带橡皮塞的 三颈烧瓶、铁架台、分液漏斗等。
三颈烧瓶、铁架台、分液漏斗等。
试剂: 铁粉、
铁粉、 溶液。
溶液。
【实验步骤】向三颈烧瓶中加入 铁粉,将
铁粉,将 溶液滴入铁粉中,同时插入pH传感器检测溶液pH的变化,实验装置(夹持装置已省略)及测得的pH变化曲线如图所示。
溶液滴入铁粉中,同时插入pH传感器检测溶液pH的变化,实验装置(夹持装置已省略)及测得的pH变化曲线如图所示。
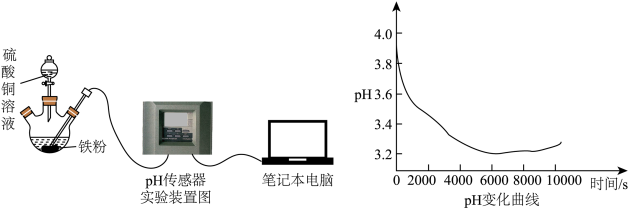
(2)乙同学猜想反应过程中pH下降与亚铁离子和溶液中氧气反应有关,理由是_______ (写离子方程式;常温下, 在
在 时完全沉淀)。
时完全沉淀)。
(3)为了验证猜想,乙同学用煮沸后冷却的蒸馏水新配制 溶液,重新进行实验。
溶液,重新进行实验。
①配制 溶液所用的蒸馏水需提前煮沸、冷却的目的是
溶液所用的蒸馏水需提前煮沸、冷却的目的是_______ ,配制 溶液需要称量
溶液需要称量_______ (保留小数点后一位) 。
。
②下列实验操作会使所配制的溶液浓度偏高的是_______ (填标号)。
a.所称量的 失去部分结晶水
失去部分结晶水
b.容量瓶洗净后刻度线下残留少量水未处理
c.移液后未洗涤烧杯和玻璃棒
d.未用 溶液润洗容量瓶
溶液润洗容量瓶
③改进之后测得溶液pH的变化趋势为_______ ,证明乙同学的猜想正确(忽略容器内空气对实验的影响)。
(1)甲同学提出硫酸铜溶液显酸性,理由是
Ⅱ.乙同学用pH传感器测铁粉和
【实验用品】仪器:pH传感器、笔记本电脑、带橡皮塞的
试剂:
【实验步骤】向三颈烧瓶中加入

(2)乙同学猜想反应过程中pH下降与亚铁离子和溶液中氧气反应有关,理由是
(3)为了验证猜想,乙同学用煮沸后冷却的蒸馏水新配制
①配制
②下列实验操作会使所配制的溶液浓度偏高的是
a.所称量的
b.容量瓶洗净后刻度线下残留少量水未处理
c.移液后未洗涤烧杯和玻璃棒
d.未用
③改进之后测得溶液pH的变化趋势为
22-23高二下·河北秦皇岛·期末
类题推荐
某同学为研究 、
、 进行了如下实验:
进行了如下实验:
【实验一】配制 的
的 实验操作:
实验操作:
①将称量好的 固体放入小烧杯中,加适量蒸馏水溶解。为加速溶解可用玻璃棒搅拌。
固体放入小烧杯中,加适量蒸馏水溶解。为加速溶解可用玻璃棒搅拌。
②将①所得溶液冷却到室温后,小心转入___________(填仪器名称)中。
③用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液都转入上述容器并摇匀。
④继续加蒸馏水至液面距刻度线1~2cm处,改用___________(填仪器名称),小心滴加蒸馏水至溶液凹液面最低点与刻度线相切。
⑤将容量瓶瓶塞塞紧,充分摇匀。
请回答下列问题:
(1)在以上实验操作的横线处填写正确答案___________ 、___________ 。
(2)计算需要无水 固体的质量
固体的质量___________ g;若无操作③会造成所配溶液浓度___________ (填“偏大”或“偏小”或“无影响”)。
(3)若用以上 的
的 溶液配制
溶液配制 溶液。需要
溶液。需要 的
的 溶液
溶液___________ mL。
【实验二】
(4)室温下, 的溶解度大于
的溶解度大于 的实验证据是
的实验证据是___________ 。
(5)该实验___________ (填能或不能)说明 溶液的碱性强于
溶液的碱性强于 溶液,理由是
溶液,理由是___________ 。
【实验三】资料:pH越小, 越小,溶液碱性越弱。
越小,溶液碱性越弱。
(6)实验二中,向澄清石灰水滴加 溶液,
溶液, 未参与该反应的实验证据是
未参与该反应的实验证据是___________ 。
(7)实验二中,滴加 溶液的pH变化与滴加
溶液的pH变化与滴加 溶液的有明显差异,结合离子方程式说明原因
溶液的有明显差异,结合离子方程式说明原因___________ 。
(8)为测定 和
和 混合物中
混合物中 的质量分数,同学们取a g混合物充分加热,称量固体质量减少b g,则混合物中
的质量分数,同学们取a g混合物充分加热,称量固体质量减少b g,则混合物中 的质量分数是
的质量分数是___________ (用含a、b的代数式表示)。
【实验一】配制
①将称量好的
②将①所得溶液冷却到室温后,小心转入___________(填仪器名称)中。
③用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液都转入上述容器并摇匀。
④继续加蒸馏水至液面距刻度线1~2cm处,改用___________(填仪器名称),小心滴加蒸馏水至溶液凹液面最低点与刻度线相切。
⑤将容量瓶瓶塞塞紧,充分摇匀。
请回答下列问题:
(1)在以上实验操作的横线处填写正确答案
(2)计算需要无水
(3)若用以上
【实验二】
| 序号 | 操作 | ||
| ① | 在两支试管中分别加入 | 温度由17.6℃变为23.2℃;放置到室温时,试管内无固体 | 温度由17.6℃变为17.2℃;放置到室温时,试管内有少量固体残留 |
| ② | 室温时,分别向①所得溶液中滴入2滴酚酞溶液 | 溶液变红 | 溶液微红 |
(4)室温下,
(5)该实验
【实验三】资料:pH越小,
| 实验操作 | 实验数据 |
测量下述实验过程的pH变化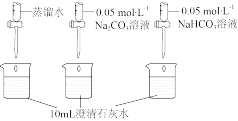 | 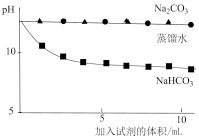 |
(6)实验二中,向澄清石灰水滴加
(7)实验二中,滴加
(8)为测定
某课外兴趣小组为拓展对SO2还原性和氧化性的认识,进行了下列两组探究实验。
(1)探究SO2和Fe(NO3)3溶液反应,反应装置如图所示: 的Fe(NO3)3溶液的pH=1;该实验条件下不考虑
的Fe(NO3)3溶液的pH=1;该实验条件下不考虑 被酸性KMnO4溶液氧化。
被酸性KMnO4溶液氧化。
回答下列问题:
①盛装浓硫酸的仪器名称为_______ 。
②Fe(NO3)3的阴离子中,N的sp2杂化轨道与O的2p轨道形成_______ 键。
③如图进行实验,装置B中产生了白色沉淀,其成分是_______ (填化学式)。
分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;
猜想2:在酸性条件下SO2与 反应;
反应;
猜想3:……
④甲同学从装置B中取出少量反应后的溶液,该溶液能使KMnO4溶液褪色。
【得出结论】猜想1成立。该结论正确吗?_______ (填“是”或“否”)。若不正确,理由是_______ (正确无需回答)。
⑤请你设计实验验证猜想2,并完成表中内容(提示: 在不同条件下的还原产物较复杂,有时难以观察到气体产生。除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等。)
在不同条件下的还原产物较复杂,有时难以观察到气体产生。除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等。)
⑥尾气处理装置应选择_______ (填序号)。 水溶液显棕色,
水溶液显棕色,
①通过上述两组对比实验,SO2与铜反应的条件是_______ 。
②写出SO2在盐酸中和铜反应的离子方程式:_______ 。
(1)探究SO2和Fe(NO3)3溶液反应,反应装置如图所示:
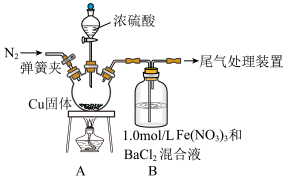
回答下列问题:
①盛装浓硫酸的仪器名称为
②Fe(NO3)3的阴离子中,N的sp2杂化轨道与O的2p轨道形成
③如图进行实验,装置B中产生了白色沉淀,其成分是
分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;
猜想2:在酸性条件下SO2与
猜想3:……
④甲同学从装置B中取出少量反应后的溶液,该溶液能使KMnO4溶液褪色。
【得出结论】猜想1成立。该结论正确吗?
⑤请你设计实验验证猜想2,并完成表中内容(提示:
| 实验步骤 | 预期现象和结论 |
| a.配溶液,用NaNO3和盐酸配成pH= b.打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹。打开分液漏斗活塞,向三颈烧瓶中滴加浓硫酸并加热。 | 若装置B中有白色沉淀生成,猜想2成立。 若装置B中无白色沉淀生成,猜想2不成立。 |
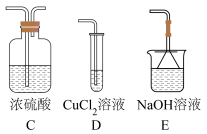
实验I 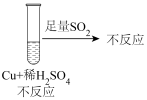
实验Ⅱ 
①通过上述两组对比实验,SO2与铜反应的条件是
②写出SO2在盐酸中和铜反应的离子方程式:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网