解答题-实验探究题 较难0.4 引用1 组卷201
碘及其化合物在生产生活中有重要作用。
(1)单质碘可与氢气反应生成碘化氢。将物质的量比为 2:1 的氢气和碘蒸气放入密闭容器中进行反应:H2(g)+I2(g)=2HI(g),反应经过 5 分钟测得碘化氢的浓度为 0.1mol·L-1,碘蒸气的浓度为 0.05mol·L-1。
①前 5 分钟平均反应速率 v(H2)=_______ ,H2的初始浓度是_______ 。
②下列能说明反应已达平衡状态的是_______ (填序号)。
a.氢气的生成速率等于碘化氢的消耗速率
b.单位时间内断裂的 H-H 键数目与断裂的 H-I 键数目相等
c.c(H2):c(I2):c(HI)=1:1:2
d.2v(I2)正=v(HI)逆
e.反应混合体系的颜色不再发生变化
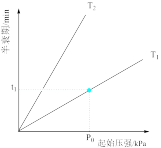
(2)已知:2N2O=2N2 +O2,不同温度(T)下,N2O 分解半衰期随起始压强的变化关系如图所示( 图中半衰期指任一浓度 N2O消耗一半时所需的相应时间) ,则 T1_______ T2(填“>”、“=”或“<”)。当温度为 T1、起始压强为p0,反应至 t1min 时,此时体系压强 p=_______ (用 p0 表示)。
(3)某小组同学在室温下进行“碘钟实验”:将浓度均为 0.01mol·L-1的 H2O2、H2SO4、HI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。
已知:“碘钟实验”的总反应的离子方程式为 H2O2+2S2O +2H+=S4O
+2H+=S4O +2H2O
+2H2O
反应分两步进行:
反应 A:……反应 B:I2+2S2O =2I-+S4O
=2I-+S4O
①反应 A 的离子方程式是_______ 。对于总反应,I-的作用是_______
②为探究溶液变蓝快慢的影响因素,进行实验 Ⅰ、Ⅱ(溶液浓度均为 0.01mol·L-1)。
溶液从混合时的无色变为蓝色的时间:实验 Ⅰ是 30min、实验 Ⅱ是 40min。实验Ⅱ中,x、y、z 所对成的数值分别是_______ ;对比实验 Ⅰ、Ⅱ,可得出的实验结论是________
(1)单质碘可与氢气反应生成碘化氢。将物质的量比为 2:1 的氢气和碘蒸气放入密闭容器中进行反应:H2(g)+I2(g)=2HI(g),反应经过 5 分钟测得碘化氢的浓度为 0.1mol·L-1,碘蒸气的浓度为 0.05mol·L-1。
①前 5 分钟平均反应速率 v(H2)=
②下列能说明反应已达平衡状态的是
a.氢气的生成速率等于碘化氢的消耗速率
b.单位时间内断裂的 H-H 键数目与断裂的 H-I 键数目相等
c.c(H2):c(I2):c(HI)=1:1:2
d.2v(I2)正=v(HI)逆
e.反应混合体系的颜色不再发生变化
(2)已知:2N2O=2N2 +O2,不同温度(T)下,N2O 分解半衰期随起始压强的变化关系如图所示( 图中半衰期指任一浓度 N2O消耗一半时所需的相应时间) ,则 T1

(3)某小组同学在室温下进行“碘钟实验”:将浓度均为 0.01mol·L-1的 H2O2、H2SO4、HI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。
已知:“碘钟实验”的总反应的离子方程式为 H2O2+2S2O
反应分两步进行:
反应 A:……反应 B:I2+2S2O
①反应 A 的离子方程式是
②为探究溶液变蓝快慢的影响因素,进行实验 Ⅰ、Ⅱ(溶液浓度均为 0.01mol·L-1)。
| 试剂 用量(mL) 序号 | H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | KI 溶液(含淀粉) | H2O |
| 实验 Ⅰ | 5 | 4 | 8 | 3 | 0 |
| 实验 Ⅱ | 5 | 2 | x | y | z |
22-23高一下·山东东营·阶段练习
类题推荐
I. 将2molSO2、1molO2和1molSO3投入恒温恒容的密闭容器中发生: 2SO2(g)+O2(g)  2SO3(g)反应
2SO3(g)反应
(1)下列说明反应达到平衡状态的是_______ (填序号)。
①气体密度不变;
②混合气体的总物质的量不变;
③混合气体的平均相对分子质量不变;
④SO2 和O2的物质的量之比不变;
⑤消耗的SO2与消耗SO3的速率相等;
⑥2v(SO2)消耗= v(O2)生成;
(2)达到平衡时,n(SO3)的取值范围_______ 。
II.碘及其化合物在生产生活中有重要作用。
(3)将0.4mol氢气和0.2mol碘蒸气放入2L密闭容器中进行反应: H2(g)+I2(g) 2HI(g),反应经过5min测得碘化氢的浓度为0.1mol·L-1,碘蒸气的浓度为0.05mol·L-1
2HI(g),反应经过5min测得碘化氢的浓度为0.1mol·L-1,碘蒸气的浓度为0.05mol·L-1
①前5min平均反应速率v(H2)=_______ , 此时H2的浓度是_______ 。
②I2(g)的转化率为_______ 。
③生成的HI(g)的体积分数为_______ (保留三位有效数字)。
(4)某小组同学在室温下进行“碘钟实验”:将浓度均为0.01mol· L-1的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一段时间后溶液变为蓝色。
已知:“碘钟实验”的总反应的离子方程式为H2O2+2S2O +2H+=S4O
+2H+=S4O +2H2O
+2H2O
反应分两步进行:
反应A: H2O2+2I-+2H+=I2 +2H2O
反应B: I2+2S2O =2I-+S4O
=2I-+S4O
①对于总反应,I-的作用是_______ 。
②为探究溶液出现蓝色快慢的影响因素,进行实验I、II,溶液浓度均为0.01mol·L-1。
溶液从混合时的无色变为蓝色的时间:实验I是30min、实验II是40min。实验II中,Z所对应的数值是_______ ;对比实验I、II,可得出的实验结论是_______ 。
(1)下列说明反应达到平衡状态的是
①气体密度不变;
②混合气体的总物质的量不变;
③混合气体的平均相对分子质量不变;
④SO2 和O2的物质的量之比不变;
⑤消耗的SO2与消耗SO3的速率相等;
⑥2v(SO2)消耗= v(O2)生成;
(2)达到平衡时,n(SO3)的取值范围
II.碘及其化合物在生产生活中有重要作用。
(3)将0.4mol氢气和0.2mol碘蒸气放入2L密闭容器中进行反应: H2(g)+I2(g)
①前5min平均反应速率v(H2)=
②I2(g)的转化率为
③生成的HI(g)的体积分数为
(4)某小组同学在室温下进行“碘钟实验”:将浓度均为0.01mol· L-1的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一段时间后溶液变为蓝色。
已知:“碘钟实验”的总反应的离子方程式为H2O2+2S2O
反应分两步进行:
反应A: H2O2+2I-+2H+=I2 +2H2O
反应B: I2+2S2O
①对于总反应,I-的作用是
②为探究溶液出现蓝色快慢的影响因素,进行实验I、II,溶液浓度均为0.01mol·L-1。
| 序号 | 试剂和用量(mL) | ||||
| H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | KI溶液含淀粉 | H2O | |
| 实验I | 5 | 4 | 8 | 3 | 0 |
| 实验II | 5 | 2 | X | Y | Z |
溶液从混合时的无色变为蓝色的时间:实验I是30min、实验II是40min。实验II中,Z所对应的数值是
I.将2molSO2、1molO2 和1molSO3投入恒温恒容的密闭容器中发生: 2SO2(g)+O2(g)  2SO3(g)反应。
2SO3(g)反应。
(1)下列说明反应达到平衡状态的是_______ (填序号)。
①气体密度不变;
②混合气体的总物质的量不变;
③混合气体的平均相对分子质量不变;
④SO2和O2的物质的量之比不变;
⑤消耗的SO2与消耗SO3的速率相等;
⑥2v(SO2)消耗= v(O2)生成;
(2)达到平衡时, n(SO3)的取值 范围_______ 。
II.碘及其化合物在生产生活中有重要作用。
(3)将0.4mol氢气和0.2mol碘蒸气放入2L密闭容器中进行反应: H2(g)+I2(g) 2HI(g),反应经过5min测得碘化氢的浓度为0.1mol·L-1),碘蒸气的浓度为0.05mol·L-1
2HI(g),反应经过5min测得碘化氢的浓度为0.1mol·L-1),碘蒸气的浓度为0.05mol·L-1
①前5min平均反应速率v(H2)=_______ 。
②I2(g)的转化率为_______ 。
③生成的HI(g)的体积分数为_______ (保留 三位有效数字)。
(4)某小组同学在室温下进行“碘钟实验”:将浓度均为0.01mol ·L-1的H2O2、H2SO4、 KI、Na2S2O3溶液及淀粉混合,一段时间后溶液变为蓝色。
已知:“碘钟实验”的总反应的离子方程式为H2O2+2S2O +2H+=S4O
+2H+=S4O +2H2O
+2H2O
反应分两步进行:
反应A: H2O2+2I-+2H+=I2 +2H2O
反应B: I2+2S2O =2I-+ S4O
=2I-+ S4O
①对于总反应,I-的作用是_______ 。
②为探究溶液出现蓝色快慢的影响因素,进行实验I、II, 溶液浓度均为0.01mol·L-1。
溶液从混合时的无色变为蓝色的时间:实验I是30min、实验II是40min。实验II中,Z所对应的数值是_______ ; 对比实验I、II, 可得出的实验结论是_______ 。
(1)下列说明反应达到平衡状态的是
①气体密度不变;
②混合气体的总物质的量不变;
③混合气体的平均相对分子质量不变;
④SO2和O2的物质的量之比不变;
⑤消耗的SO2与消耗SO3的速率相等;
⑥2v(SO2)消耗= v(O2)生成;
(2)达到平衡时, n(SO3)的取值 范围
II.碘及其化合物在生产生活中有重要作用。
(3)将0.4mol氢气和0.2mol碘蒸气放入2L密闭容器中进行反应: H2(g)+I2(g)
①前5min平均反应速率v(H2)=
②I2(g)的转化率为
③生成的HI(g)的体积分数为
(4)某小组同学在室温下进行“碘钟实验”:将浓度均为0.01mol ·L-1的H2O2、H2SO4、 KI、Na2S2O3溶液及淀粉混合,一段时间后溶液变为蓝色。
已知:“碘钟实验”的总反应的离子方程式为H2O2+2S2O
反应分两步进行:
反应A: H2O2+2I-+2H+=I2 +2H2O
反应B: I2+2S2O
①对于总反应,I-的作用是
②为探究溶液出现蓝色快慢的影响因素,进行实验I、II, 溶液浓度均为0.01mol·L-1。
| 序号 | 试剂和用量(mL) | ||||
| H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | KI溶液含淀粉 | H2O | |
| 实验I | 5 | 4 | 8 | 3 | 0 |
| 实验II | 5 | 2 | X | Y | Z |
Ⅰ、将2 mol SO2、1 mol O2和1 mol SO3投入恒温恒容的密闭容器中发生:2SO2(g)+O2(g)  2SO3(g)反应。
2SO3(g)反应。
(1)下列说明反应达到平衡状态的是___________ (填序号)。
①气体密度不变;
②混合气体的总物质的量不变;
③混合气体的平均相对分子质量不变;
④SO2 和O2的物质的量之比不变;
⑤消耗的SO2与消耗SO3的速率相等;
⑥2v(SO2)消耗=v(O2)生成;
(2)达到平衡时,n(SO3)的取值范围:___________ 。
Ⅱ、碘及其化合物在生产生活中有重要作用。
(3)将0.4 mol氢气和0.2 mol碘蒸气放入2 L密闭容器中进行反应 H2(g)+I2(g)⇌2HI(g),反应经过5 min测得碘化氢的浓度为0.1 mol·L−1,碘蒸气的浓度为0.05 mol·L−1。
①前5 min平均反应速率v(H2)=___________ 此时H2的浓度是___________ 。
②I2(g)的转化率为___________ 。
③生成的HI(g)的体积分数为___________ (保留三位有效数字)。
(4)某小组同学在室温下进行“碘钟实验”:将浓度均为0.01 mol· L−1的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一段时间后溶液变为蓝色。
已知:“碘钟实验”的总反应的离子方程式为H2O2+2 +2H+=
+2H+= +2H2O
+2H2O
反应分两步进行:反应A:H2O2+2I-+2H+=I2+2H2O 反应B:I2+2 =2I-+
=2I-+
①对于总反应,I-的作用是___________ 。
②为探究溶液出现蓝色快慢的影响因素,进行实验Ⅰ、Ⅱ,溶液浓度均为0.01 mol·L−1.
溶液从混合时的无色变为蓝色的时间:实验Ⅰ是30 min、实验Ⅱ是40 min。对比实验Ⅰ、Ⅱ,可得出的实验结论是___________ 。
(1)下列说明反应达到平衡状态的是
①气体密度不变;
②混合气体的总物质的量不变;
③混合气体的平均相对分子质量不变;
④SO2 和O2的物质的量之比不变;
⑤消耗的SO2与消耗SO3的速率相等;
⑥2v(SO2)消耗=v(O2)生成;
(2)达到平衡时,n(SO3)的取值范围:
Ⅱ、碘及其化合物在生产生活中有重要作用。
(3)将0.4 mol氢气和0.2 mol碘蒸气放入2 L密闭容器中进行反应 H2(g)+I2(g)⇌2HI(g),反应经过5 min测得碘化氢的浓度为0.1 mol·L−1,碘蒸气的浓度为0.05 mol·L−1。
①前5 min平均反应速率v(H2)=
②I2(g)的转化率为
③生成的HI(g)的体积分数为
(4)某小组同学在室温下进行“碘钟实验”:将浓度均为0.01 mol· L−1的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一段时间后溶液变为蓝色。
已知:“碘钟实验”的总反应的离子方程式为H2O2+2
反应分两步进行:反应A:H2O2+2I-+2H+=I2+2H2O 反应B:I2+2
①对于总反应,I-的作用是
②为探究溶液出现蓝色快慢的影响因素,进行实验Ⅰ、Ⅱ,溶液浓度均为0.01 mol·L−1.
| 序号 | 试剂和用量(mL) | ||||
| H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | KI溶液含淀粉 | H2O | |
| 实验Ⅰ | 5 | 4 | 8 | 3 | 0 |
| 实验Ⅱ | 5 | 2 | 8 | 3 | 2 |
溶液从混合时的无色变为蓝色的时间:实验Ⅰ是30 min、实验Ⅱ是40 min。对比实验Ⅰ、Ⅱ,可得出的实验结论是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


