填空题 适中0.65 引用1 组卷229
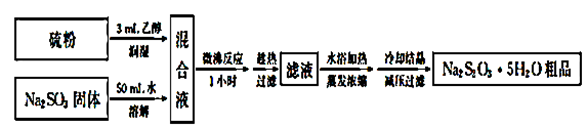
胆矾(CuSO4·5H2O)又名蓝矾,是化学工业、医药领域中的常见物质。某实验小组利用有色金属加工企业的废材制得粗胆矾晶体。
(1)制得的粗晶体中可能含有Fe2(SO4)3、FeCl3 杂质,选用下列试剂,确定所含杂质。可选试剂有:蒸馏水、稀硫酸、氨水、Ba(NO3)2 溶液、BaCl2 溶液、AgNO3 溶液。请补充以下实验步骤:
①取一定量样品,加入蒸馏水、稀硫酸,固体溶解,得到蓝色透明溶液;
②取少量①所得溶液,滴加_______ 至过量,先析出沉淀,后沉淀部分溶解,过滤得深蓝色溶液,滤渣为红褐色;
③另取少量①所得溶液,加入足量的_______ 溶液,出现白色沉淀;
④取③中所得上层清液,加入_______ 溶液,无明显现象。
实验结论:粗胆矾晶体中含有Fe2(SO4)3,不含FeCl3。
(2)CuSO4·5H2O的含量测定:
①称取1.250g产品配成100 mL溶液,取25.00 mL溶液于锥形瓶中,加入足量NaF溶液后,再滴加KI溶液至不再产生CuI沉淀;
②以淀粉溶液作为指示剂,用0.1000 mol·L-1 Na2S2O3标准溶液进行滴定,平行滴定3次。已知:Fe3++6F-= ;I2+2Na2S2O3=2NaI+Na2S4O6
;I2+2Na2S2O3=2NaI+Na2S4O6
请回答:步骤①中,加入足量NaF溶液的可能原因是_______ ,若不加NaF溶液,可导致最终的测量值_______ (填 “偏大”“偏小”或“无影响”)。滴加KI溶液生成沉淀的离子方程式为_______ ; 若Na2S2O3标准溶液的平均用量为10.00 mL,则产品中胆矾的质量分数为_______ 。
(1)制得的粗晶体中可能含有Fe2(SO4)3、FeCl3 杂质,选用下列试剂,确定所含杂质。可选试剂有:蒸馏水、稀硫酸、氨水、Ba(NO3)2 溶液、BaCl2 溶液、AgNO3 溶液。请补充以下实验步骤:
①取一定量样品,加入蒸馏水、稀硫酸,固体溶解,得到蓝色透明溶液;
②取少量①所得溶液,滴加
③另取少量①所得溶液,加入足量的
④取③中所得上层清液,加入
实验结论:粗胆矾晶体中含有Fe2(SO4)3,不含FeCl3。
(2)CuSO4·5H2O的含量测定:
①称取1.250g产品配成100 mL溶液,取25.00 mL溶液于锥形瓶中,加入足量NaF溶液后,再滴加KI溶液至不再产生CuI沉淀;
②以淀粉溶液作为指示剂,用0.1000 mol·L-1 Na2S2O3标准溶液进行滴定,平行滴定3次。已知:Fe3++6F-=
请回答:步骤①中,加入足量NaF溶液的可能原因是
2023·安徽安庆·三模
类题推荐
Ⅰ.常温下,几种物质的溶度积常数见表:
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净的CuCl2溶液,宜加入___ (填一种)调节溶液pH,使Fe3+转化为Fe(OH)3沉淀。
(2)过滤后,将所得滤液经过___ 操作,可得到CuCl2·2H2O晶体。
(3)由CuCl2·2H2O晶体得到纯的无水CuCl2,需要进行的操作是___ 。
(4)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取8.0g试样溶于水配成250mL溶液,取25.00mL溶液,加入过量KI固体,充分反应,生成白色沉淀。用0.1000mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00mL。(已知:I2+2S2O =S4O
=S4O +2I-)。
+2I-)。
①CuCl2溶液与KI反应的离子方程式为___ 。
②该试样中CuCl2·2H2O的质量百分数为___ 。(保留一位小数)
Ⅱ.某实验小组采用沉淀滴定法测定碳酸氢钠样品中杂质Cl-的含量,实验步骤如下:
①用天平称取ag碳酸氢钠样品,用蒸馏水溶解,再用足量稀硝酸酸化,配成100mL待测液;
②用移液管移取20.00mL待测液于锥形瓶中,并滴加1~2滴指示剂;
③用cmol·L-1AgNO3标准溶液滴定Cl-,三次滴定结果如下:
已知:
(5)滴定时可选为滴定指示剂的是___ (填编号)。
(6)到达滴定终点的标志是___ 。
(7)当Cl-恰好完全沉淀,则此时溶液中的c(CrO )为
)为__ mol·L-1。
(8)根据上述数据计算碳酸氢钠样品中杂质Cl-的质量分数为___ 。
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)过滤后,将所得滤液经过
(3)由CuCl2·2H2O晶体得到纯的无水CuCl2,需要进行的操作是
(4)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取8.0g试样溶于水配成250mL溶液,取25.00mL溶液,加入过量KI固体,充分反应,生成白色沉淀。用0.1000mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00mL。(已知:I2+2S2O
①CuCl2溶液与KI反应的离子方程式为
②该试样中CuCl2·2H2O的质量百分数为
Ⅱ.某实验小组采用沉淀滴定法测定碳酸氢钠样品中杂质Cl-的含量,实验步骤如下:
①用天平称取ag碳酸氢钠样品,用蒸馏水溶解,再用足量稀硝酸酸化,配成100mL待测液;
②用移液管移取20.00mL待测液于锥形瓶中,并滴加1~2滴指示剂;
③用cmol·L-1AgNO3标准溶液滴定Cl-,三次滴定结果如下:
| V(待测液)/mL | 20.00 | 20.00 | 20.00 |
| V(AgNO3)/mL | 19.98 | 20.00 | 20.02 |
| 银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 黄 | 白 | 砖红 | 白 |
| Ksp | 2.0×10-10 | 8.3×10-17 | 1.2×10-16 | 1.0×10-12 | 1.0×10-12 |
| A.NaCl | B.K2CrO4 | C.KI | D.NaCN |
(7)当Cl-恰好完全沉淀,则此时溶液中的c(CrO
(8)根据上述数据计算碳酸氢钠样品中杂质Cl-的质量分数为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网