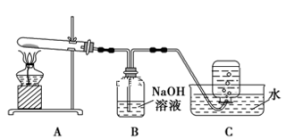
解答题-实验探究题 适中0.65 引用5 组卷850
Cu与浓 反应是中学阶段一个重要反应,某兴趣小组对实验中的一些现象及产物进行实验探究。
反应是中学阶段一个重要反应,某兴趣小组对实验中的一些现象及产物进行实验探究。
(1)Cu与浓 反应的离子方程式为
反应的离子方程式为_______ 。
(2)关于该实验下列说法错误的是_______ 。
A.该反应需要加热才能进行 B.可通过抽动铜丝控制反应的开始和停止
C.反应后迅速生成大量红棕色气体 D.烧杯中仅发生中和反应
(3)小组同学发现Cu与浓 反应所得混合溶液为绿色,Cu与稀
反应所得混合溶液为绿色,Cu与稀 反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。
反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。
【提出猜想】
猜想a: 浓度大
浓度大
猜想b: 溶解在
溶解在 溶液中
溶液中
猜想c:由于 与水反应能够生成
与水反应能够生成 ,
, 与
与 能够发生可逆反应
能够发生可逆反应 (绿色)
(绿色)
【实验探究】
实验i:配制饱和 溶液,溶液呈蓝色。
溶液,溶液呈蓝色。
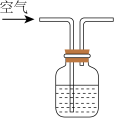
实验ii:取适量Cu与浓 反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到
反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到_______ ,5min后,溶液完全变为蓝色。
实验iii:取适量Cu与浓 反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。
反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。
对比实验ii与实验iii,可推测 溶液为绿色的原因主要是
溶液为绿色的原因主要是_______ 。
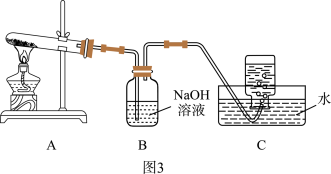
(4)小组同学还针对产物 的热稳定性进行探究。在如图3所示的实验装置A中,用酒精喷灯对
的热稳定性进行探究。在如图3所示的实验装置A中,用酒精喷灯对 固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为
固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为 。当反应结束以后,试管中残留固体为红色。
。当反应结束以后,试管中残留固体为红色。_______ 装置。
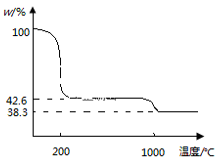
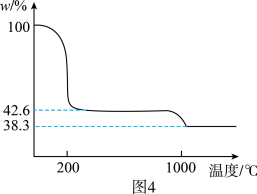
②图4为 样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。
样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。 加热到200℃的化学方程式为
加热到200℃的化学方程式为_______ ,继续高温至1000℃生成_______ (填化学式)固体。
(1)Cu与浓
(2)关于该实验下列说法错误的是
A.该反应需要加热才能进行 B.可通过抽动铜丝控制反应的开始和停止
C.反应后迅速生成大量红棕色气体 D.烧杯中仅发生中和反应
(3)小组同学发现Cu与浓
【提出猜想】
猜想a:
猜想b:
猜想c:由于
【实验探究】
实验i:配制饱和
实验ii:取适量Cu与浓
实验iii:取适量Cu与浓
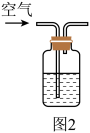
对比实验ii与实验iii,可推测
(4)小组同学还针对产物
②图4为
2023·福建泉州·模拟预测
类题推荐
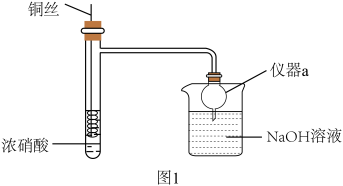
HNO3是重要的化工原料,浓HNO3与Cu反应的装置如图1所示:
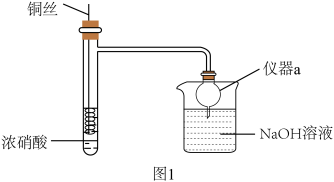
回答下列问题:
(1)仪器a的名称是_______ ,在该实验中的作用为_______ 。
(2)关于该实验下列说法错误的是_______。
(3)某小组同学发现Cu与浓HNO3反应所得混合溶液为绿色,Cu与稀HNO3反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。
【提出猜想】
猜想a:Cu(NO3)2浓度大
猜想b:NO2溶解在Cu(NO3)2溶液中
【实验验证】
实验i:配制饱和Cu(NO3)2溶液,溶液呈_______ 色,证明猜想a不成立。
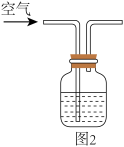
实验ii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到_______ ,5min后,溶液完全变为蓝色,证明猜想b成立。
(4)另一组同学查阅资料发现:NO2能与水反应生成HNO2,进而发生下述反应:
①由此该组同学认为通过实验说明猜想b成立不严谨,理由是_______ 。
②写出NO2与水反应生成HNO2的化学方程式_______ 。
③该组同学改进后设计了新的实验:
实验iii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。对比实验ii与实验iii,可推测Cu(NO3)2溶液为绿色的原因主要是_______ 。

回答下列问题:
(1)仪器a的名称是
(2)关于该实验下列说法错误的是_______。
| A.该反应需要加热才能进行 | B.可通过抽动铜丝控制反应开始和停止 |
| C.反应后迅速生成大量红棕色气体 | D.烧杯中仅发生中和反应 |
【提出猜想】
猜想a:Cu(NO3)2浓度大
猜想b:NO2溶解在Cu(NO3)2溶液中
【实验验证】
实验i:配制饱和Cu(NO3)2溶液,溶液呈
实验ii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到

(4)另一组同学查阅资料发现:NO2能与水反应生成HNO2,进而发生下述反应:
①由此该组同学认为通过实验说明猜想b成立不严谨,理由是
②写出NO2与水反应生成HNO2的化学方程式
③该组同学改进后设计了新的实验:
实验iii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。对比实验ii与实验iii,可推测Cu(NO3)2溶液为绿色的原因主要是
某小组同学发现Cu与浓 反应所得混合溶液为绿色,Cu与稀
反应所得混合溶液为绿色,Cu与稀 反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。
反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。
下列说法不正确的是
| 实验猜想:猜想a: | |
| 实验方案 | |
| 方案1 | 配制饱和 |
| 方案2 | 取适量Cu与浓 |
| 方案3 | 加热该绿色溶液,观察溶液颜色 |
| 资料卡片:① | |
| A.Cu与浓 |
| B.方案1中若配得溶液呈蓝色,则证明猜想a不成立 |
| C.方案2中溶液上方看到生成红棕色气体,则证明猜想b一定成立 |
| D.方案3观察到溶液上方生成红棕色气体,溶液完全变为蓝色 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网